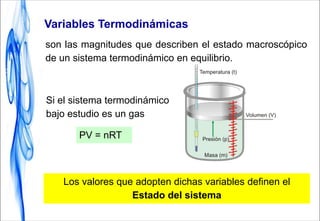
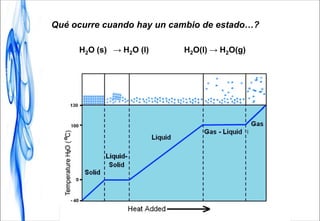
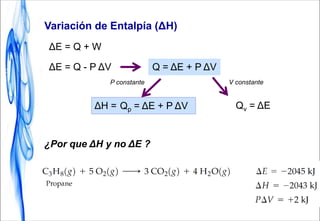
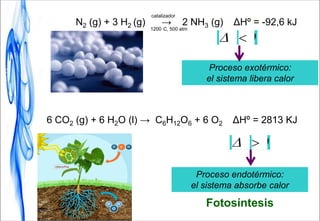
Este documento trata sobre la termodinámica. Introduce conceptos clave como sistema, calor, trabajo, energía interna, entalpía y reacciones químicas. Explica que la termodinámica estudia el intercambio de energía en sistemas y permite predecir la espontaneidad de procesos físicos y químicos. Además, presenta la primera ley de la termodinámica sobre la conservación de la energía.












































![¿Cómo se determinan los ΔH f?
Método
directo
Método
indirecto
Calorimetro: Para compuestos que se
obtienen fácilmente a partir de sus
elementos
kJHgCOgOgrafC o
f 5,393)()()( 22
kJH
gOHgrafCHgCOHH
o
f
o
f
o
f
o
f
o
f
5,393
)],(),([),( 22
Utilizar la Ley de Hess](https://image.slidesharecdn.com/termodinmica-150427112414-conversion-gate02/85/Termodinamica-49-320.jpg)













![Cómo podemos calcular los cambios de
entropía de un sistema?
Tercer principio de la termodinámica
La entropía de un cristal perfecto a cero Kelvin es cero
Entropía estándar So de una sustancia es la entropía que gana al
transformarse desde un cristal perfecto a cero K hasta las
condiciones de estado estándar (1 atm y 25oC)
?o
rSdDcCbBaA
)]()([)]()([ BbSAaSDdSCcSS ooooo
r
)react.()prod.( o
r
o
p
o
r SSS](https://image.slidesharecdn.com/termodinmica-150427112414-conversion-gate02/85/Termodinamica-63-320.jpg)

