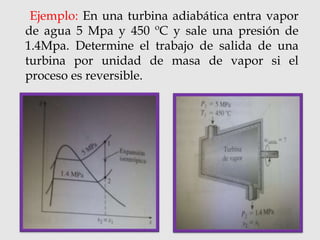
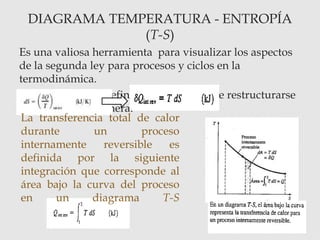
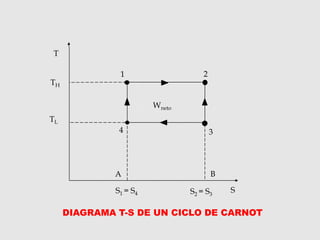
Este documento presenta información sobre procesos isentrópicos en los que la entropía se mantiene constante (Δs = 0). Incluye un ejemplo numérico para calcular el trabajo de salida de una turbina de vapor. También describe diagramas T-S y cómo se usan para analizar procesos termodinámicos, incluido el ciclo de Carnot.