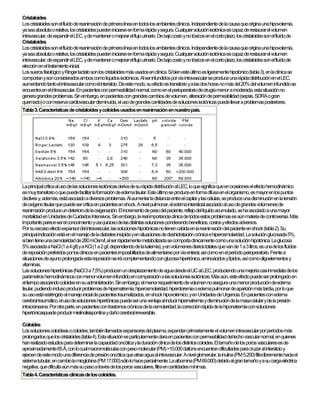
Cristaloides
- 1. Cristaloides Los cristaloides son el fluído de reanimación de primera línea en todos los ambientes clínicos. Independiente de la causa que origina una hipovolemia, ya sea absoluta o relativa, los cristaloides pueden iniciarse en forma rápida y segura. Cualquier solución isotónica es capaz de restaurar el volumen intravascular, de expandir el LEC, y de mantener o mejorar el flujo urinario. De bajo costo y no tóxicos en el corto plazo, los cristaloides son el fluído de Cristaloides Los cristaloides son el fluído de reanimación de primera línea en todos los ambientes clínicos. Independiente de la causa que origina una hipovolemia, ya sea absoluta o relativa, los cristaloides pueden iniciarse en forma rápida y segura. Cualquier solución isotónica es capaz de restaurar el volumen intravascular, de expandir el LEC, y de mantener o mejorar el flujo urinario. De bajo costo y no tóxicos en el corto plazo, los cristaloides son el fluído de elección en el tratamiento inicial. Los sueros fisiológico y Ringer lactato son los cristaloides más usados en clínica. Si bien este último es ligeramente hipotónico (tabla 3), en la clínica se comportan y son considerados ambos como líquidos isotónicos. Al ser infundidos por vía intravascular se produce una rápida distribución en el LEC, aumentando tanto el intravascular como el intersticio. De este modo, su efecto es transitorio y a las dos horas no más del 20% del volumen infundido se encuentra en el intravascular. En pacientes con permeabilidad normal, como en el perioperatorio de cirugía menor a moderada, esta situación no genera grandes problemas. Sin embargo, en pacientes con grandes cambios de volumen, alteración de permeabilidad (sepsis, SDRA o gran quemado) o con reserva cardiovascular disminuída, el uso de grandes cantidades de soluciones isotónicas puede llevar a problemas posteriores. Tabla 3. Características de cristaloides y coloides usados en reanimación en nuestro país. La principal crítica al uso de las soluciones isotónicas deriva de su rápida distribución al LEC, lo que significa que en ocasiones el efecto hemodinámico es muy transitorio o que puede facilitar la formación de edema tisular. Este último se produce en forma difusa en el organismo, es mayor en los puntos declives y, además, está asociado a diversos problemas. Al aumentar la distancia entre el capilar y las células, se produce una disminución en la tensión de oxígeno tisular que puede ser crítica en pacientes en shock. A nivel pulmonar, el edema intersticial asociado al uso de grandes volúmenes de reanimación produce un deterioro de la oxigenación. El incremento de peso del paciente, reflejo del líquido acumulado, se ha asociado a una mayor mortalidad en Unidades de Cuidados Intensivos. Sin embargo, la real importancia clínica de todos estos problemas es aún materia de controversia. Más importante parece ser el conocimiento y uso juicioso de las distintas soluciones ponderando beneficios, costos y efectos adversos. Por su escaso efecto expansor del intravascular, las soluciones hipotónicas no tienen cabida en la reanimación del paciente en shock (tabla 2). Su principal indicación está en el manejo de la diabetes insípida y en situaciones de deshidratación crónica e hiperosmolaridad. La solución glucosada 5%, si bien tiene una osmolaridad de 280 mOsm/l, al ser rápidamente metabolizada se comporta clínicamente como una solución hipotónica. La glucosa 5% asociada a NaCl (1 a 4 g/l) y a KCl (1 a 2 g/l, dependiendo de la kalemia), y en volúmenes diarios totales que van de 1 a 3 litros, es una de los fluídos de reposición preferidos por los clínicos en pacientes imposibilitados de alimentarse por vía enteral, así como en el período perioperatorio. Frente a situaciones de ayuno prolongada esta reposición se irá complementando con glucosa hipertónica, aminoácidos y lípidos, así como oligoelementos y vitaminas. Las soluciones hipertónicas (NaCl 3 a 7,5%) producen un desplazamiento de agua desde el LIC al LEC, produciendo una mejoría casi inmediata de los parámetros hemodinámicos con menor volumen infundido en comparación a las soluciones isotónicas. Más aún, este efecto puede ser prolongado en el tiempo asociando coloides en su administración. Sin embargo, el menor requerimiento de volumen no asegura una menor producción de edema tisular, pudiendo incluso producir problemas de hipernatremia, hiperosmolaridad, hipercloremia o edema pulmonar de aparición más tardía, por lo que su uso está restringido al manejo inicial de pacientes traumatizados, en shock hipovolémico, y en Unidades de Urgencia. En pacientes con edema cerebral traumático, el uso de soluciones hipertónicas puede ser una ventaja al inducir hipernatremia y disminución de la masa celular y de la presión intracraneana. Por otra parte, en pacientes con trastornos crónicos de la osmolaridad, la corrección rápida de la hiponatremia con soluciones hipertónicaspuede producir mielinolisispontina y daño cerebral irreversible. Coloides Los soluciones coloídeas o coloides, también llamados expansores del plasma, expanden primariamente el volumen intravascular por períodos más prolongados que los cristaloides (tabla 4). Esta situación es particularmente clara en pacientes con permeabilidad del lecho vascular normal, en quienes han realizado estudios para determinar la capacidad oncótica y la duración clínica de los distintos coloides. El tamaño de los poros vasculares es de aproximadamente 65 Å, con lo cual macromoléculas con peso molecular (PM) >10.000 daltons encuentran dificultades para cruzar al intersticio y ejercen de este modo una diferencia de presión oncótica que atrae agua al intravascular. A nivel glomerular, la inulina (PM 5.200) filtra libremente hacia el sistema tubular, en cambio la mioglobina (PM 17.000) sólo lo hace parcialmente. La albúmina (PM 69.000) debido al gran tamaño y a su carga eléctrica negativa, que dificulta aún más su paso a través de los poros vasculares, filtra en cantidades mínimas. Tabla 4. Características clínicas de los coloides.
- 2. La capacidad de mantener el volumen administrado en el espacio intravascular depende del PM y, como se ha mencionado, de la permeabilidad vascular. Mientras mayor sea el tamaño de la molécula mayor será su efecto sobre la PCO y más tiempo permanecerá en el organismo hasta ser excretada o metabolizada. Sin embargo, a diferencia de la albúmina, los coloides sintéticos son suspensiones con moléculas de tamaños y pesos moleculares diferentes, y el PM que se describe es el PM promedio de las distintas moléculas. Así, la real capacidad oncótica de un coloide estará dada, más que por su peso molecular, por el número de moléculas con PM mayor a 20.000 o 30.000 daltons. La gran ventaja del uso de coloides con respecto a los cristaloides está en su mayor capacidad de mantener el volumen intravascular. A igual volumen de solución infundida habría mejores parámetros hemodinámicos y menor edema intersticial. Sin embargo, en pacientes con permeabilidad vascular aumentada los coloides filtran con mayor facilidad hacia el extravascular, pudiendo ejercer presión oncótica en ese compartimiento, incrementar el edema intersticial y hacer más difícil su manejo. En pacientes con insuficiencia respiratoria grave, el uso de coloides puede significar un deterioro grave en los parámetros de oxigenación. Por mucho tiempo el expansor plasmático más usado fue el plasma fresco congelado, sin embargo, cuando se conocieron sus problemas éste dejó de ser indicado para la expansión del volumen intravascular y, hoy en día, su uso se limita a defectos hemostáticos. El desarrollo tecnológico permitió la producción industrial de albúmina humana como expansor plasmático, la cual es considerada el coloide ideal por excelencia debido a su larga permanencia en el intravascular y ausencia de efectos adversos importantes. Sin embargo, su elevado costo ha llevado al desarrollo de otras macromoléculas de origen vegetal y animal que son los llamados coloides sintéticos. Estos, a diferencia de la albúmina, son moléculas polidispersas, vale decir de diferentes pesos moleculares, pero con capacidades oncóticas similares y de bastante menor costo. Albúmina La albúmina es la proteína más abundante en el compartimiento extracelular, con un pool total de aproximadamente 5 g/Kg. El 30-40% se encuentra en el intravascular, y el resto en el intersticio con una distribución heterogénea en los diferentes órganos. La albúmina representa el 50% de la síntesis proteica hepática (aproximadamente 0,2 g/Kg/día), y es responsable del 70 a 80% de la PCO del plasma. El fraccionamiento de las proteínas plasmáticas y la preparación industrial de albúmina ha sido desarrollado en los últimos veinte años. La albúmina preparada comercialmente en Chile es hiperoncótica (Albúmina 20%, 10 g en frasco de 50 ml), y aumenta el intravascular cuatro veces en relación al volumen administrado, pudiendo hacerse isooncótica (3 a 5%) si se diluye en algún cristaloide. Luego de su fraccionamiento del plasma humano, la albúmina es pasteurizada, de modo que no existe posibilidad de transmisión de enfermedades virales, sin embargo, sí puede producirse reacciones alérgicas por la presencia de pirógenos. La albúmina humana es el expansor plasmático natural contra el cual los coloides sintéticos son comparados. A diferencia de éstos, la albúmina posee una característica única cual es ser una solución monodispersa, o sea todas las moléculas son del mismo tamaño (69.000 Da). Su vida media es de 18 horas, y la duración clínica de 6 a 12 horas dependiendo de la patología subyacente. La gran ventaja del uso de albúmina y otros coloides con respecto a los cristaloides está en su mayor capacidad de mantener el volumen intravascular. A igual volumen de solución infundida habría mejores parámetros hemodinámicos y menor edema intersticial. Sin embargo, en pacientes con permeabilidad vascular aumentada, los coloides filtran con mayor facilidad hacia el extravascular, pudiendo ejercer su presión oncótica en ese compartimiento e incrementar el edema intersticial. A pesar de que la albúmina al 3-5% es considerada por muchos como el "coloide ideal", su uso es restringido por el alto costo de la solución. Como sustituto plasmático sólo es extensamente usada en Estados Unidos, debido a que escasos coloides sintéticos han sido aprobados por la FDA. En Europa, en cambio, la gran diversidad de coloides sintéticos disponibles, hacen a éstos los sustitutos del plasma ideales por su bajo costo en comparación a la albúmina. Aparte de su efecto expansor plasmático, la albúmina también ha sido usada para corregir el edema secundario a hipoalbuminemia crónica, como pacientes desnutridos, o aquellos portadores de insuficiencia hepática o sindromenefrósico. Coloides sintéticos A diferencia de la albúmina, los coloides sintéticos son suspensiones con moléculas de tamaños y pesos moleculares diferentes. Las sustancias más usadas son las gelatinas, los dextranos y los almidones (tabla 4). Dextranos La molécula del dextrán o dextrano es un polisacárido monocuaternario de origen bacteriano. Las principales soluciones disponibles son de PM promedio de 70.000, 60.000 o 40.000 Da, ésta última la más usada en Chile (Dextrán-40). Su uso como expansor del plasma va en franca disminución debido a sus efectos adversos, principalmente aquellos relacionados con la coagulación, siendo reemplazados en favor de almidones y gelatinas. Después de su infusión, la eliminación del dextrán ocurre por diversas vías, siendo la más importante la vía renal. La aparición de una insuficiencia renal oligoanúrica es una complicación más bien excepcional y se ha descrito con el uso de dextrán-40 al 10%. Si bien el poder oncótico es alto, 1 gramo de dextrán puede retener hasta 30 ml de agua, su duración es bastante limitada y no va más allá de 3 a 4 horas. Después de una perfusión de dextrán-40, la mitad es eliminada a las dos horas y a las seis horas sólo un 20% permanece en el intravascular. El dextrán tiene propiedades antitrombóticas importantes, al alterar la adhesividad plaquetaria y deprimir la actividad del factor VIII. Las anormalidades de la hemostasia inducida por los dextranos son similares a las observadas en la enfermedad de von Willebrand. Por lo general, se observa un aumento en el tiempo de sangría después de la administración de más de 1,5 g/Kg de dextrán. Además, los dextranos disminuyen la viscosidad sanguínea favoreciendo la circulación. Así, más que como expansor plasmático, es usado por sus efectos reológicos y antitrombóticos en situaciones de bajo flujo a
- 3. nivel microcirculatorio, como revascularización de extremidades en pacientes diabéticos, manejo de vasoespasmo cerebral, y prevención de trombosis venosa profunda. El dextrán también puede producir liberación de histamina y reacciones anafilácticas severas. El estudio de Laxenaire en Francia mostró una incidencia similar de reacciones anafilácticas que las gelatinas, sin embargo, los casos graves fueron más frecuentes. La posibilidad de bloquear estas reacciones inmunológicas con el uso de su hapteno (dextrán 1.000 Da) es cierta, por lo que su uso es recomendado previo al uso de cualquier dextrano. Gelatinas Las gelatinas son obtenidas por degradación del colágeno de origen animal. A través de diversos procesos es posible obtener gelatinas fluídas modificadas o gelatinas con puentes de urea, ambas con PM promedios de 35.000 Da. Las características clínicas de ambas son similares de modo que hablaremos brevemente de ellas en forma genérica. Su poder oncótico es menor a la albúmina y su vida media en el intravascular relativamente corta, de 2 a 3 horas, siendo eliminadas rápidamente por filtración glomerular. Si bien existe filtración hacia el intersticio, básicamente no está descrita su acumulación en el organismo. Esto, asociado a la escasa incidencia de efectos a nivel renal o de la coagulación, permite que no haya dosis límites establecidas para las gelatinas. No obstante, como se mencionó, el poder oncótico y la duración en el intravascular es bastante modesto e inferior a la albúmina, los dextranos y los HES de PM alto e intermedio (tabla 4). El estudio de Laxenaire identificó cuatro variables asociadas a reacciones anafilactoídeas por el uso de coloides: antecedentes de alergia medicamentosa, sexo masculino, y el uso de dextranos y gelatinas. Si bien los problemas alérgicos con las gelatinas son frecuentes, éstos rara vez son severos. En conclusión, el uso de las gelatinas es apta para la mayoría de las situaciones clínicas que requieran de una reposición o expansión del volumen plasmático. Si bien su efecto oncótico es más débil y de menor duración que los otros sustitutos plasmáticos, no se le reconocen efectos adversos sobre la función renal y coagulación. Por este motivo no existe una dosis máxima que no debe ser sobrepasada y, junto a los HES de PM medio, son los coloides sintéticos más usados en la actualidad en nuestro país y en Europa. Hidroxietilalmidones (HES) Los almidones son polímeros naturales de glucosa derivados de la amilopectina, generalmente provenientes del maíz o trigo. Las soluciones de almidón natural son muy inestables en el plasma al ser rápidamente metabolizadas por las amilasas. La hidroxietilación o esterificación en diversas posiciones de la molécula permite retardar esta hidrólisis confiriéndole una gran estabilidad a la solución. Los almidones más estables y usados en clínica son los hidroxietilalmidones (HES, por su nombre en inglés hydroxyethylstarch), y a ellos nos referiremos a continuación. Las características fundamentales que determinan la actividad oncótica y la duración de los HES que usamos en clínica son el número de moléculas y su peso molecular (PM), y el grado y tipo de hidroxietilación. La actividad coloídea u oncótica depende primariamente del número de moléculas en la solución y su PM. Originalmente, el PM fue considerado el factor principal para describir las características clínicas de los HES. Sin embargo, el número de moléculas y el tipo de sustitución con radicales hidroxietilos son más importantes para definir el comportamiento de los HES. Al ser moléculas polidispersas, o sea de diferentes pesos moleculares, el PM sólo refleja el PM promedio y no habla de la dispersión en el tamaño de las moléculas. De hecho, el número de moléculas es fundamental en la actividad oncótica de los HES, ya que a igual concentración el número de moléculas, que es inversa al PM promedio de la solución, determinará la actividad oncótica del HES. La cinética de los almidones mejora con la adición de radicales hidroxietilos, prolongando así su vida media. El grado de sustitución molar de un HES está determinado por el número de unidades de glucosa hidroxietiladasdividada por las unidades de glucosa presentes. Mientras mayor sea el número de unidades hidroxietiladas, mayor es el grado de sustitución y mayor la vida media de la molécula en el plasma, variando el grado de sustitución de 0,4 a 0,7. Un grado de sustitución de 0,5 indica que hay 5 unidades hidroxietiladas por cada 10 moléculas de glucosa. Además, la hidroxietilación ocurre en diversos sitios de la molécula de glucosa, siendo la posición en el carbono 2 la más frecuente y la más resistente a la hidrólisis. De este modo, el tipo de sustitución también influye en la vida media del HES, lo cual se identifica por el radio C2/C6. Mientras mayor sea este radio, vale decir más moléculas hidroxietiladas en el carbono 2 que en el carbono 6, más lenta será la metabolización del HES. Diferentes moléculas y de diversos orígenes han sido utilizadas en varios países. Al no existir un consenso universal, lo más apropiado es definir los HES de acuerdo a su PM y al grado de sustitución molar, los cuales representan en forma bastante adecuada las características farmacokinéticas de los HES. En Estados Unidos, el HES 450/0,7 (Hespan® o Hetastarch®) es el único aprobado por la FDA y el que presenta la mayor incidencia de efectos adversos posee, especialmente a nivel de la coagulación. Además, su monopolio conlleva un alto costo que lo hace comparable a la albúmina en este aspecto. En Europa, en cambio, varios HES de PM intermedio (200 a 300 KDa) han sido usados como sustitutos plasmáticos, siendo de mucho menor costo y con un perfil clínico muy superior al Hetastarch®. En nuestro país, el HAES-steril® (HES 200/0,5) comparte estas características de bajo costo, actividad oncótica prolongada y escasos efectos adversos. Poco después de la administración de una solución de HES, la distribución de las moléculas circulantes se hace menos dispersa y el PM promedio más pequeño que en la solución in vitro. Esto se produce porque las moléculas con un PM menor a 50.000 Da son rápidamente eliminadas por excreción renal y las moléculas más grandes parcialmente hidrolizadas por la amilasa. Esto explica también la corta vida media de las gelatinas, rápidamente eliminadas por vía renal debido a su menor PM. El patrón de cambio en las soluciones de HES de PM intermedio es similar, disminuyendo el PM in vivo a 70 a 120 KDa en las primeras horas después de la infusión. La hidrólisis limitada de las moléculas aumenta su número e incrementa el efecto osmótico ya que, como se dijo, éste es proporcional al número de moléculas circulantes. La relación C2/C6 del HES circulante también aumenta ya que las moléculas con sustitución C2 resisten más la hidrólisis. En cuanto a la duración del efecto expansor de los HES, la tasa de hidroxietilación es fundamental en su vida media. Así, los HES de alto peso molecular, con grados de sustitución de 0,7, tienen una duración superior a las 24 horas. Algunas de las moléculas de mayor tamaño pueden incluso permanecer varios días en la circulación, existiendo el riesgo de acumulación de éstas frente a dosis repetidas de HES de alto peso molecular. Los HES de PM intermedio, como HAESsteril® (200/0,5) tienen una vida media plasmática entre 4 y 6 horas y una duración clínica que puede alcanzar las 12 horas, con escaso riesgo de acumulación. Para moléculas de PM intermedio pero con mayor grado de sustitución (HES 200/0,62), también llamados de eliminación retardada, la duración puede alcanzar a 18 o 24 horas.
- 4. A la fecha, el mecanismo preciso de eliminación aún es materia de debate. El rol del sistema reticuloendotelial en fagocitar las moléculas más grandes está descrito para los HES de alto PM y alto grado de sustitución, como el HES 450/0,7. Para las moléculas de PM intermedio (p.e. HAESsteril®) y PM pequeño la eliminación renal tiene un rol primordial y no se produce acumulación de éstas en el organismo. Después de analizados las características físico-químicas y farmacokinéticas queda claro que no todos los HES tienen los mismos efectos clínicos. Para fines prácticos, los HES son definidos por su PM y su grado de sustitución, siendo los HES de PM intermedio los más usados en Europa y, a nuestro juicio, los más adecuados para la expansión del volumen intravascular. Existen múltiples datos referentes a la magnitud y duración del efecto expansor del plasma de los HES. Los sujetos estudiados varían de voluntarios normales a pacientes con grandes trastornos de la permeabilidad vascular, lo que dificulta la interpretación de los datos. Ciertos modelos utilizados, como el shock séptico, el shock hemorrágico y la circulación extracorpórea alteran profundamente la permeabilidad capilar y, por consiguiente, el volumen de distribución de los sustitutos plasmáticos. La volemia inicial y la existencia de una eventual depleción proteica también influye directamente en los resultados. Finalmente, la concentración, el volumen y la velocidad de infusión de la solución son otros factores a considerar en la conducta del HES en el organismo y, en particular, su capacidad de expandir el volumen intravascular. Según estos conceptos, el efecto clínico de los HES debe evaluarse en las diversas situaciones clínicas, ya que cada una presenta una respuesta particular frente al aporte de estas soluciones. En este número analizaremos el caso de pacientes sometidos a anestesia y cirugía, para continuar con otras situaciones clínicas como trauma, reanimación o sepsis en publicaciones futuras. Se ha demostrado que no todos los HES tienen la misma repercusión sobre la coagulación y, eventualmente, la posibilidad de producir complicaciones hemorrágicas. Varios estudios han mostrado que los HES de PM alto (HES 450/0,7, Hespan® o Hetastarch®) producen aumento del tiempo de sangría, disminución en el tiempo de protrombina y disminución del factor VIII coagulante y von Willebrand. Así, como los dextranos, los HES de PM alto producen un defecto similar a la enfermedad de von Willebrand. Estos efectos son menores y transitorios si el HES 450/0,7 es usado en cantidades moderadas, esto es menor a 20 ml/Kg o 1.500 ml/día. Sin embargo, varios casos clínicos reportados de hemorragia perioperatoria asociadas al uso de HES 450/0,7 han sembrado un temor injustificado al uso de HES de PM intermedio. Diversos estudios han mostrado que los efectos de los HES sobre la coagulación son producidos por las moléculas de gran tamaño, las cuales son difíciles de eliminar, y que están presentes en los HES de PM alto y alto grado de hidroxietilación. El efecto de los HES de PM intermedio y bajo grado de hidroxietilación (HES 200/0,5) sobre la coagulación es prácticamente nulo y no sería causa de problemas hemorragíparos. El riesgo de reacciones anafilactoídeas es bajo, similar al que se presenta a la albúmina, y de magnitud leve. El riesgo de estas reacciones se ha estimado 4 a 6 veces menor que las gelatinas y dextranos. Regularmente se observa un aumento de las amilasas séricas, que no tiene relevancia clínica. No hay datos que sostengan un efecto adverso de los HES sobre la función renal. Sin embargo, hay que señalar que el sindrome de insuficiencia renal aguda hiperoncótica, inicialmente descrito con los dextranos, puede suceder con cualquier agente coloídeohiperoncótico. El mecanismo de esta complicación es por un aumento de la presión coloido-oncótica plasmática que se opone a la presión de filtración hidrostática glomerular, y también se ha descrito para la albúmina, gelatinas y HES. La mayoría de estos pacientes presentan también otros factores de riesgo como deterioro previo de la función renal y estados de hipoperfusión. ¿Coloides o cristaloides? A la fecha, no existen estudios randomizados, prospectivos y multicéntricos que comparen diferentes soluciones de reanimación y que muestren ventajas de alguna en términos de morbilidad o mortalidad. Datos derivados de pequeñas casuísticas en humanos y otros provenientes de estudios en animales han sido usados para argumentar los beneficios de una u otra solución. En general, es aceptado que se requiere más volumen de cristaloides, de 3 a 6 veces, que de coloides para lograr una misma meta fisiológica. Sin embargo los coloides son más caros y tienen más reacciones adversas potenciales. De este modo, el real costo-beneficio del uso de los coloides versus cristaloides es discutido y debe evaluarse para cada situación en particular. Lo más importante es identificar los efectos fisiológicos que se desea obtener, y utilizar con criterio las distintas soluciones para lograr esas metas. elección en el tratamiento inicial. Los sueros fisiológico y Ringer lactato son los cristaloides más usados en clínica. Si bien este último es ligeramente hipotónico (tabla 3), en la clínica se comportan y son considerados ambos como líquidos isotónicos. Al ser infundidos por vía intravascular se produce una rápida distribución en el LEC, aumentando tanto el intravascular como el intersticio. De este modo, su efecto es transitorio y a las dos horas no más del 20% del volumen infundido se encuentra en el intravascular. En pacientes con permeabilidad normal, como en el perioperatorio de cirugía menor a moderada, esta situación no genera grandes problemas. Sin embargo, en pacientes con grandes cambios de volumen, alteración de permeabilidad (sepsis, SDRA o gran quemado) o con reserva cardiovascular disminuída, el uso de grandes cantidades de soluciones isotónicas puede llevar a problemas posteriores. Tabla 3. Características de cristaloides y coloides usados en reanimación en nuestro país.
- 5. La principal crítica al uso de las soluciones isotónicas deriva de su rápida distribución al LEC, lo que significa que en ocasiones el efecto hemodinámico es muy transitorio o que puede facilitar la formación de edema tisular. Este último se produce en forma difusa en el organismo, es mayor en los puntos declives y, además, está asociado a diversos problemas. Al aumentar la distancia entre el capilar y las células, se produce una disminución en la tensión de oxígeno tisular que puede ser crítica en pacientes en shock. A nivel pulmonar, el edema intersticial asociado al uso de grandes volúmenes de reanimación produce un deterioro de la oxigenación. El incremento de peso del paciente, reflejo del líquido acumulado, se ha asociado a una mayor mortalidad en Unidades de Cuidados Intensivos. Sin embargo, la real importancia clínica de todos estos problemas es aún materia de controversia. Más importante parece ser el conocimiento y uso juicioso de las distintas soluciones ponderando beneficios, costos y efectos adversos. Por su escaso efecto expansor del intravascular, las soluciones hipotónicas no tienen cabida en la reanimación del paciente en shock (tabla 2). Su principal indicación está en el manejo de la diabetes insípida y en situaciones de deshidratación crónica e hiperosmolaridad. La solución glucosada 5%, si bien tiene una osmolaridad de 280 mOsm/l, al ser rápidamente metabolizada se comporta clínicamente como una solución hipotónica. La glucosa 5% asociada a NaCl (1 a 4 g/l) y a KCl (1 a 2 g/l, dependiendo de la kalemia), y en volúmenes diarios totales que van de 1 a 3 litros, es una de los fluídos de reposición preferidos por los clínicos en pacientes imposibilitados de alimentarse por vía enteral, así como en el período perioperatorio. Frente a situaciones de ayuno prolongada esta reposición se irá complementando con glucosa hipertónica, aminoácidos y lípidos, así como oligoelementos y vitaminas. Las soluciones hipertónicas (NaCl 3 a 7,5%) producen un desplazamiento de agua desde el LIC al LEC, produciendo una mejoría casi inmediata de los parámetros hemodinámicos con menor volumen infundido en comparación a las soluciones isotónicas. Más aún, este efecto puede ser prolongado en el tiempo asociando coloides en su administración. Sin embargo, el menor requerimiento de volumen no asegura una menor producción de edema tisular, pudiendo incluso producir problemas de hipernatremia, hiperosmolaridad, hipercloremia o edema pulmonar de aparición más tardía, por lo que su uso está restringido al manejo inicial de pacientes traumatizados, en shock hipovolémico, y en Unidades de Urgencia. En pacientes con edema cerebral traumático, el uso de soluciones hipertónicas puede ser una ventaja al inducir hipernatremia y disminución de la masa celular y de la presión intracraneana. Por otra parte, en pacientes con trastornos crónicos de la osmolaridad, la corrección rápida de la hiponatremia con soluciones hipertónicaspuede producir mielinolisispontina y daño cerebral irreversible. Coloides Los soluciones coloídeas o coloides, también llamados expansores del plasma, expanden primariamente el volumen intravascular por períodos más prolongados que los cristaloides (tabla 4). Esta situación es particularmente clara en pacientes con permeabilidad del lecho vascular normal, en quienes han realizado estudios para determinar la capacidad oncótica y la duración clínica de los distintos coloides. El tamaño de los poros vasculares es de aproximadamente 65 Å, con lo cual macromoléculas con peso molecular (PM) >10.000 daltons encuentran dificultades para cruzar al intersticio y ejercen de este modo una diferencia de presión oncótica que atrae agua al intravascular. A nivel glomerular, la inulina (PM 5.200) filtra libremente hacia el sistema tubular, en cambio la mioglobina (PM 17.000) sólo lo hace parcialmente. La albúmina (PM 69.000) debido al gran tamaño y a su carga eléctrica negativa, que dificulta aún más su paso a través de los poros vasculares, filtra en cantidades mínimas. Tabla 4. Características clínicas de los coloides. La capacidad de mantener el volumen administrado en el espacio intravascular depende del PM y, como se ha mencionado, de la permeabilidad vascular. Mientras mayor sea el tamaño de la molécula mayor será su efecto sobre la PCO y más tiempo permanecerá en el organismo hasta ser excretada o metabolizada. Sin embargo, a diferencia de la albúmina, los coloides sintéticos son suspensiones con moléculas de tamaños y pesos moleculares diferentes, y el PM que se describe es el PM promedio de las distintas moléculas. Así, la real capacidad oncótica de un coloide estará dada, más que por su peso molecular, por el número de moléculas con PM mayor a 20.000 o 30.000 daltons. La gran ventaja del uso de coloides con respecto a los cristaloides está en su mayor capacidad de mantener el volumen intravascular. A igual volumen de solución infundida habría mejores parámetros hemodinámicos y menor edema intersticial. Sin embargo, en pacientes con permeabilidad vascular aumentada los coloides filtran con mayor facilidad hacia el extravascular, pudiendo ejercer presión oncótica en ese compartimiento, incrementar el edema intersticial y hacer más difícil su manejo. En pacientes con insuficiencia respiratoria grave, el uso de coloides puede significar un deterioro grave en los parámetros de oxigenación. Por mucho tiempo el expansor plasmático más usado fue el plasma fresco congelado, sin embargo, cuando se conocieron sus problemas éste dejó de ser indicado para la expansión del volumen intravascular y, hoy en día, su uso se limita a defectos hemostáticos. El desarrollo tecnológico permitió la producción industrial de albúmina humana como expansor plasmático, la cual es considerada el coloide ideal por excelencia debido a su larga permanencia en el intravascular y ausencia de efectos adversos importantes. Sin embargo, su elevado costo ha llevado al desarrollo de otras macromoléculas de origen vegetal y animal que son los llamados coloides sintéticos. Estos, a diferencia de la albúmina, son moléculas polidispersas, vale decir de diferentes pesos moleculares, pero con capacidades oncóticas similares y de bastante menor costo. Albúmina La albúmina es la proteína más abundante en el compartimiento extracelular, con un pool total de aproximadamente 5 g/Kg. El 30-40% se encuentra en el intravascular, y el resto en el intersticio con una distribución heterogénea en los diferentes órganos. La albúmina representa el 50% de la síntesis
- 6. proteica hepática (aproximadamente 0,2 g/Kg/día), y es responsable del 70 a 80% de la PCO del plasma. El fraccionamiento de las proteínas plasmáticas y la preparación industrial de albúmina ha sido desarrollado en los últimos veinte años. La albúmina preparada comercialmente en Chile es hiperoncótica (Albúmina 20%, 10 g en frasco de 50 ml), y aumenta el intravascular cuatro veces en relación al volumen administrado, pudiendo hacerse isooncótica (3 a 5%) si se diluye en algún cristaloide. Luego de su fraccionamiento del plasma humano, la albúmina es pasteurizada, de modo que no existe posibilidad de transmisión de enfermedades virales, sin embargo, sí puede producirse reacciones alérgicas por la presencia de pirógenos. La albúmina humana es el expansor plasmático natural contra el cual los coloides sintéticos son comparados. A diferencia de éstos, la albúmina posee una característica única cual es ser una solución monodispersa, o sea todas las moléculas son del mismo tamaño (69.000 Da). Su vida media es de 18 horas, y la duración clínica de 6 a 12 horas dependiendo de la patología subyacente. La gran ventaja del uso de albúmina y otros coloides con respecto a los cristaloides está en su mayor capacidad de mantener el volumen intravascular. A igual volumen de solución infundida habría mejores parámetros hemodinámicos y menor edema intersticial. Sin embargo, en pacientes con permeabilidad vascular aumentada, los coloides filtran con mayor facilidad hacia el extravascular, pudiendo ejercer su presión oncótica en ese compartimiento e incrementar el edema intersticial. A pesar de que la albúmina al 3-5% es considerada por muchos como el "coloide ideal", su uso es restringido por el alto costo de la solución. Como sustituto plasmático sólo es extensamente usada en Estados Unidos, debido a que escasos coloides sintéticos han sido aprobados por la FDA. En Europa, en cambio, la gran diversidad de coloides sintéticos disponibles, hacen a éstos los sustitutos del plasma ideales por su bajo costo en comparación a la albúmina. Aparte de su efecto expansor plasmático, la albúmina también ha sido usada para corregir el edema secundario a hipoalbuminemia crónica, como pacientes desnutridos, o aquellos portadores de insuficiencia hepática o sindromenefrósico. Coloides sintéticos A diferencia de la albúmina, los coloides sintéticos son suspensiones con moléculas de tamaños y pesos moleculares diferentes. Las sustancias más usadas son las gelatinas, los dextranos y los almidones (tabla 4). Dextranos La molécula del dextrán o dextrano es un polisacárido monocuaternario de origen bacteriano. Las principales soluciones disponibles son de PM promedio de 70.000, 60.000 o 40.000 Da, ésta última la más usada en Chile (Dextrán-40). Su uso como expansor del plasma va en franca disminución debido a sus efectos adversos, principalmente aquellos relacionados con la coagulación, siendo reemplazados en favor de almidones y gelatinas. Después de su infusión, la eliminación del dextrán ocurre por diversas vías, siendo la más importante la vía renal. La aparición de una insuficiencia renal oligoanúrica es una complicación más bien excepcional y se ha descrito con el uso de dextrán-40 al 10%. Si bien el poder oncótico es alto, 1 gramo de dextrán puede retener hasta 30 ml de agua, su duración es bastante limitada y no va más allá de 3 a 4 horas. Después de una perfusión de dextrán-40, la mitad es eliminada a las dos horas y a las seis horas sólo un 20% permanece en el intravascular. El dextrán tiene propiedades antitrombóticas importantes, al alterar la adhesividad plaquetaria y deprimir la actividad del factor VIII. Las anormalidades de la hemostasia inducida por los dextranos son similares a las observadas en la enfermedad de von Willebrand. Por lo general, se observa un aumento en el tiempo de sangría después de la administración de más de 1,5 g/Kg de dextrán. Además, los dextranos disminuyen la viscosidad sanguínea favoreciendo la circulación. Así, más que como expansor plasmático, es usado por sus efectos reológicos y antitrombóticos en situaciones de bajo flujo a nivel microcirculatorio, como revascularización de extremidades en pacientes diabéticos, manejo de vasoespasmo cerebral, y prevención de trombosis venosa profunda. El dextrán también puede producir liberación de histamina y reacciones anafilácticas severas. El estudio de Laxenaire en Francia mostró una incidencia similar de reacciones anafilácticas que las gelatinas, sin embargo, los casos graves fueron más frecuentes. La posibilidad de bloquear estas reacciones inmunológicas con el uso de su hapteno (dextrán 1.000 Da) es cierta, por lo que su uso es recomendado previo al uso de cualquier dextrano. Gelatinas Las gelatinas son obtenidas por degradación del colágeno de origen animal. A través de diversos procesos es posible obtener gelatinas fluídas modificadas o gelatinas con puentes de urea, ambas con PM promedios de 35.000 Da. Las características clínicas de ambas son similares de modo que hablaremos brevemente de ellas en forma genérica. Su poder oncótico es menor a la albúmina y su vida media en el intravascular relativamente corta, de 2 a 3 horas, siendo eliminadas rápidamente por filtración glomerular. Si bien existe filtración hacia el intersticio, básicamente no está descrita su acumulación en el organismo. Esto, asociado a la escasa incidencia de efectos a nivel renal o de la coagulación, permite que no haya dosis límites establecidas para las gelatinas. No obstante, como se mencionó, el poder oncótico y la duración en el intravascular es bastante modesto e inferior a la albúmina, los dextranos y los HES de PM alto e intermedio (tabla 4). El estudio de Laxenaire identificó cuatro variables asociadas a reacciones anafilactoídeas por el uso de coloides: antecedentes de alergia medicamentosa, sexo masculino, y el uso de dextranos y gelatinas. Si bien los problemas alérgicos con las gelatinas son frecuentes, éstos rara vez son severos. En conclusión, el uso de las gelatinas es apta para la mayoría de las situaciones clínicas que requieran de una reposición o expansión del volumen plasmático. Si bien su efecto oncótico es más débil y de menor duración que los otros sustitutos plasmáticos, no se le reconocen efectos adversos sobre la función renal y coagulación. Por este motivo no existe una dosis máxima que no debe ser sobrepasada y, junto a los HES de PM medio, son los coloides sintéticos más usados en la actualidad en nuestro país y en Europa. Hidroxietilalmidones (HES) Los almidones son polímeros naturales de glucosa derivados de la amilopectina, generalmente provenientes del maíz o trigo. Las soluciones de almidón natural son muy inestables en el plasma al ser rápidamente metabolizadas por las amilasas. La hidroxietilación o esterificación en diversas posiciones de la molécula permite retardar esta hidrólisis confiriéndole una gran estabilidad a la solución. Los almidones más estables y usados en clínica son los hidroxietilalmidones (HES, por su nombre en inglés hydroxyethylstarch), y a ellos nos referiremos a continuación. Las características fundamentales que determinan la actividad oncótica y la duración de los HES que usamos en clínica son el número de moléculas y su peso molecular (PM), y el grado y tipo de hidroxietilación. La actividad coloídea u oncótica depende primariamente del número de moléculas en la solución y su PM. Originalmente, el PM fue considerado el factor principal para describir las características clínicas de los HES. Sin embargo, el número de moléculas y el tipo de sustitución con radicales hidroxietilos son más importantes para definir el comportamiento de los HES. Al ser moléculas
- 7. polidispersas, o sea de diferentes pesos moleculares, el PM sólo refleja el PM promedio y no habla de la dispersión en el tamaño de las moléculas. De hecho, el número de moléculas es fundamental en la actividad oncótica de los HES, ya que a igual concentración el número de moléculas, que es inversa al PM promedio de la solución, determinará la actividad oncótica del HES. La cinética de los almidones mejora con la adición de radicales hidroxietilos, prolongando así su vida media. El grado de sustitución molar de un HES está determinado por el número de unidades de glucosa hidroxietiladasdividada por las unidades de glucosa presentes. Mientras mayor sea el número de unidades hidroxietiladas, mayor es el grado de sustitución y mayor la vida media de la molécula en el plasma, variando el grado de sustitución de 0,4 a 0,7. Un grado de sustitución de 0,5 indica que hay 5 unidades hidroxietiladas por cada 10 moléculas de glucosa. Además, la hidroxietilación ocurre en diversos sitios de la molécula de glucosa, siendo la posición en el carbono 2 la más frecuente y la más resistente a la hidrólisis. De este modo, el tipo de sustitución también influye en la vida media del HES, lo cual se identifica por el radio C2/C6. Mientras mayor sea este radio, vale decir más moléculas hidroxietiladas en el carbono 2 que en el carbono 6, más lenta será la metabolización del HES. Diferentes moléculas y de diversos orígenes han sido utilizadas en varios países. Al no existir un consenso universal, lo más apropiado es definir los HES de acuerdo a su PM y al grado de sustitución molar, los cuales representan en forma bastante adecuada las características farmacokinéticas de los HES. En Estados Unidos, el HES 450/0,7 (Hespan® o Hetastarch®) es el único aprobado por la FDA y el que presenta la mayor incidencia de efectos adversos posee, especialmente a nivel de la coagulación. Además, su monopolio conlleva un alto costo que lo hace comparable a la albúmina en este aspecto. En Europa, en cambio, varios HES de PM intermedio (200 a 300 KDa) han sido usados como sustitutos plasmáticos, siendo de mucho menor costo y con un perfil clínico muy superior al Hetastarch®. En nuestro país, el HAES-steril® (HES 200/0,5) comparte estas características de bajo costo, actividad oncótica prolongada y escasos efectos adversos. Poco después de la administración de una solución de HES, la distribución de las moléculas circulantes se hace menos dispersa y el PM promedio más pequeño que en la solución in vitro. Esto se produce porque las moléculas con un PM menor a 50.000 Da son rápidamente eliminadas por excreción renal y las moléculas más grandes parcialmente hidrolizadas por la amilasa. Esto explica también la corta vida media de las gelatinas, rápidamente eliminadas por vía renal debido a su menor PM. El patrón de cambio en las soluciones de HES de PM intermedio es similar, disminuyendo el PM in vivo a 70 a 120 KDa en las primeras horas después de la infusión. La hidrólisis limitada de las moléculas aumenta su número e incrementa el efecto osmótico ya que, como se dijo, éste es proporcional al número de moléculas circulantes. La relación C2/C6 del HES circulante también aumenta ya que las moléculas con sustitución C2 resisten más la hidrólisis. En cuanto a la duración del efecto expansor de los HES, la tasa de hidroxietilación es fundamental en su vida media. Así, los HES de alto peso molecular, con grados de sustitución de 0,7, tienen una duración superior a las 24 horas. Algunas de las moléculas de mayor tamaño pueden incluso permanecer varios días en la circulación, existiendo el riesgo de acumulación de éstas frente a dosis repetidas de HES de alto peso molecular. Los HES de PM intermedio, como HAESsteril® (200/0,5) tienen una vida media plasmática entre 4 y 6 horas y una duración clínica que puede alcanzar las 12 horas, con escaso riesgo de acumulación. Para moléculas de PM intermedio pero con mayor grado de sustitución (HES 200/0,62), también llamados de eliminación retardada, la duración puede alcanzar a 18 o 24 horas. A la fecha, el mecanismo preciso de eliminación aún es materia de debate. El rol del sistema reticuloendotelial en fagocitar las moléculas más grandes está descrito para los HES de alto PM y alto grado de sustitución, como el HES 450/0,7. Para las moléculas de PM intermedio (p.e. HAESsteril®) y PM pequeño la eliminación renal tiene un rol primordial y no se produce acumulación de éstas en el organismo. Después de analizados las características físico-químicas y farmacokinéticas queda claro que no todos los HES tienen los mismos efectos clínicos. Para fines prácticos, los HES son definidos por su PM y su grado de sustitución, siendo los HES de PM intermedio los más usados en Europa y, a nuestro juicio, los más adecuados para la expansión del volumen intravascular. Existen múltiples datos referentes a la magnitud y duración del efecto expansor del plasma de los HES. Los sujetos estudiados varían de voluntarios normales a pacientes con grandes trastornos de la permeabilidad vascular, lo que dificulta la interpretación de los datos. Ciertos modelos utilizados, como el shock séptico, el shock hemorrágico y la circulación extracorpórea alteran profundamente la permeabilidad capilar y, por consiguiente, el volumen de distribución de los sustitutos plasmáticos. La volemia inicial y la existencia de una eventual depleción proteica también influye directamente en los resultados. Finalmente, la concentración, el volumen y la velocidad de infusión de la solución son otros factores a considerar en la conducta del HES en el organismo y, en particular, su capacidad de expandir el volumen intravascular. Según estos conceptos, el efecto clínico de los HES debe evaluarse en las diversas situaciones clínicas, ya que cada una presenta una respuesta particular frente al aporte de estas soluciones. En este número analizaremos el caso de pacientes sometidos a anestesia y cirugía, para continuar con otras situaciones clínicas como trauma, reanimación o sepsis en publicaciones futuras. Se ha demostrado que no todos los HES tienen la misma repercusión sobre la coagulación y, eventualmente, la posibilidad de producir complicaciones hemorrágicas. Varios estudios han mostrado que los HES de PM alto (HES 450/0,7, Hespan® o Hetastarch®) producen aumento del tiempo de sangría, disminución en el tiempo de protrombina y disminución del factor VIII coagulante y von Willebrand. Así, como los dextranos, los HES de PM alto producen un defecto similar a la enfermedad de von Willebrand. Estos efectos son menores y transitorios si el HES 450/0,7 es usado en cantidades moderadas, esto es menor a 20 ml/Kg o 1.500 ml/día. Sin embargo, varios casos clínicos reportados de hemorragia perioperatoria asociadas al uso de HES 450/0,7 han sembrado un temor injustificado al uso de HES de PM intermedio. Diversos estudios han mostrado que los efectos de los HES sobre la coagulación son producidos por las moléculas de gran tamaño, las cuales son difíciles de eliminar, y que están presentes en los HES de PM alto y alto grado de hidroxietilación. El efecto de los HES de PM intermedio y bajo grado de hidroxietilación (HES 200/0,5) sobre la coagulación es prácticamente nulo y no sería causa de problemas hemorragíparos. El riesgo de reacciones anafilactoídeas es bajo, similar al que se presenta a la albúmina, y de magnitud leve. El riesgo de estas reacciones se ha estimado 4 a 6 veces menor que las gelatinas y dextranos. Regularmente se observa un aumento de las amilasas séricas, que no tiene relevancia clínica. No hay datos que sostengan un efecto adverso de los HES sobre la función renal. Sin embargo, hay que señalar que el sindrome de insuficiencia renal aguda hiperoncótica, inicialmente descrito con los dextranos, puede suceder con cualquier agente coloídeohiperoncótico. El mecanismo de esta complicación es por un aumento de la presión coloido-oncótica plasmática que se opone a la presión de filtración hidrostática glomerular, y también se
- 8. ha descrito para la albúmina, gelatinas y HES. La mayoría de estos pacientes presentan también otros factores de riesgo como deterioro previo de la función renal y estados de hipoperfusión. ¿Coloides o cristaloides? A la fecha, no existen estudios randomizados, prospectivos y multicéntricos que comparen diferentes soluciones de reanimación y que muestren ventajas de alguna en términos de morbilidad o mortalidad. Datos derivados de pequeñas casuísticas en humanos y otros provenientes de estudios en animales han sido usados para argumentar los beneficios de una u otra solución. En general, es aceptado que se requiere más volumen de cristaloides, de 3 a 6 veces, que de coloides para lograr una misma meta fisiológica. Sin embargo los coloides son más caros y tienen más reacciones adversas potenciales. De este modo, el real costo-beneficio del uso de los coloides versus cristaloides es discutido y debe evaluarse para cada situación en particular. Lo más importante es identificar los efectos fisiológicos que se desea obtener, y utilizar con criterio las distintas soluciones para lograr esas metas.
