Leyes de los gases: Boyle, Charles y Gay-Lussac
- 1. CONTENIDO 1: Introducción. 2: Objetivos. 3: Procedimiento. 4: Marco Teórico. 4.1: Condiciones Físicas: 4.1,1: Temperatura. 4.1,2: Volumen. 4.1,3: Presión. 4.2: Estados de agregación. 4.2,1: Solido. 4.2,2: Liquido. 4.2,3: Gaseoso. 4.3: Leyes. 4.3,1: Ley de Boyle. 4.3,1: Ley de Charles.
- 2. 4.3,1: Ley de Gay Lussac. 4.3,1: Ley Combinada de los gases. 4.3,1: Ley de los gases ideales. 5: Actividad (Ejercicios). 5.1: Ley de Boyle. 5.2: Ley de Charles. 5.3: Ley de Gay lussac. 5.4: Gases ideales. 6: Webgrafía. INTRODUCCIÓN La química ha buscado siempre una explicación para las diferentes reacciones o preguntas ocurridas bajo determinadas condiciones.Algunas de estas preguntas han sido resueltas durante el transcurso del tiempo. Siendo así que condiciones comola temperatura, la presión, el volumen que ocupa algo, el número de moles o moléculas de una sustancia, influyen cada al momento de obtener un resultado. Científicoscomo RobertBoyle, Jacques Charles, Gay Lussac entre otros, crearon diferentes tipos de fórmulas que tiene que ver con el tema de los gases,haciendo cada uno su propia investigación y dando como aporte formulas para poderhallar la respuestade un problema.A continuación veremos las diferentes leyes que crearon cada uno de estos científicas,explicandolas de la mejor manera posible.
- 3. OBJETIVOS - Entender las leyes y las fórmulas dadas por Boyle, Charles, Gay Lussac,etc. - Realizar una correcta aplicación de las leyes enunciadas para la solución de ejercicios. - Aprenderlos procesoscorrectamente,los cuales deben ser aplicados a la hora de hacer los ejercicios. -Conocercuales son las leyes de los gases cuáles son sus fórmulas y quienes son los creadores de estas -Con las actividades podrás reforzar lo aprendido PROCEDIMIENTO 1: Se entra a Google,y en la parte superiorpegamos el link
- 4. 2: Después de esto nos aparecerá una página llamada Educaplus.org. También aparecerá un recuadro donde saldrá toda la información que hay en dicha página, incluyendo los temas de diferentes tipos de ejercicios de quimica.
- 5. 3: Observamos que nos aparece inmediatamente el primer ejercicio para resolverlo. - Podrás hacer varias veces los ejercicios para practicar. MARCO TEÓRICO CONDICIONES FÍSICAS Temperatura: La temperatura indica el grado de movimiento de las partículas de un cuerpo (Energía Cinética de las partículas). La unidad de medida establecida por el Sistema Internacional (SI) es el Kelvin (K). Sin embargo, se utiliza generalmente los grados Celsius (°C). El instrumento que se utiliza para medir la temperatura es el termómetro. Las tres escalas utilizadas son:
- 6. Escala Celsius:En esta escala, el grado 0 corresponde al punto donde el agua se solidifica y el grado 100 corresponde al punto de ebullición de la misma. Escala Absoluta Kelvin: Esta escala fue creada por Lord Kelvin, quien encontró que existe un límite inferior de temperatura por debajo de la cual no pueden enfriarse los cuerpos. Es decir, la temperatura más baja posible. Este valor corresponde a -273,15°C y es denominado cero absoluto (0 K). - Matemáticamente, para expresar en Kelvin una temperatura dada en grados Celsius se emplea la siguiente fórmula. Escala Fahrenheit: En esta escala, el 0°C, corresponde a 32°F, y 100°C equivale a 212°F. Para expresar en °C una temperatura entregada en °F se emplea la siguiente fórmula. Ejemplos: - Expresar una temperatura de 32 °C en la escala Kelvin. °Según la fórmula, sabemos los siguiente: T = t + 273,15
- 7. T = 32 + 273,15 (Por sustitución) T = 305,15K - Expresar una temperatura de 341 K en la escala Celsius. °Según la fórmula, sabemos los siguiente: T = t + 273,15 Despejando t de la ecuación t = T – 273,15 t = 341 – 273,15 t = 67,85 °C Volumen: El volumen corresponde a la medida del espacio que ocupa un cuerpo. La unidad de medida para medir volumen es el metro cúbico (m3), sin embargo generalmente se utiliza el Litro (L). El metro cúbico corresponde a medir las dimensiones de un cubo que mide 1 m de largo, 1 m de ancho y 1 m de alto.
- 8. ● La temperatura influye directamente sobre el volumen de los gases y los líquidos - Si la temperatura aumenta, los sólidos y los líquidos se dilatan. - Si la temperatura disminuye, los sólidos y los líquidos se contraen. Presión: Es la medida del efecto de la distribución de fuerzas normales (perpendiculares) aplicada sobre una superficie o área. - Para una fuerza dada, la presión obtenida sobre un área pequeña será mayor si se ejerce sobre un superficie grande, debido a su distribución. Unidades de la Presión: Por definición de presión, la unidad será el cociente de unidad de fuerza por unidad de área. ● En el Sistema Internacional de Unidades (S.I.) es : Newton / m2 , denominado Pascal (Pa). ● En el sistema técnico se utilizan: g-f / cm2 , Kg-f / cm2 , Lb-f / pulg2 = Psi (Sistema Técnico inglés). Existen otras unidades convencionales para medir presión de fluidos (líquido o un gas). Para medir presiones pequeñas, como ocurre normalmente en el laboratorio, se utiliza el milímetro de mercurio (mmHg) o Torricelli (Torr).
- 9. Cuando se desea medir presiones elevadas se utiliza la atmósfera (atm). Una atmósfera, es la presión que ejerce sobre su base una columna de mercurio de 76 cm de altura. ESTADOS DE AGREGACIÓN. Solido: - Al aumentar la temperatura, aumenta la vibración de las partículas. - Tiene forma y volumen constantes
- 10. - Las partículas que lo forman tienen unas fuerzas de atracción grandes. - Las partículas solo pueden moverse vibrando u oscilando alrededor de posiciones fijas - Forman estructuras cristalinas median dispositivos ordenados formando figuras geométricas. Ejemplos: Liquido: - Son incompresibles. - Se dilatan al calentarse y se contraen al enfriarse. - Al aumentar la T, aumenta la movilidad de las partículas. ● Los líquidos tienen volumen constante y forma variable (Se adaptan al recipiente que los contiene).
- 11. ● Las partículas están unidas por fuerzas de atracción menores que en los sólidos. ● Las partículas de los líquidos tienen capacidad para desplazarse y pasar a través de orificios pequeños. ● Debido a las fuerzas de rozamiento de sus partículas, tienen mayor o menor facilidad para moverse. Ejemplos: Gaseoso:
- 12. Presentan la propiedad de expansibilidad y compresibilidad ya que sus moléculas se mueven libremente y ocupan todo el espacio disponible. La compresibilidad tiene limite y si se reduce mucho el volumen en el que se recoge el gas, éste pasará al estado líquido. - No tiene forma fija ni volumen fijo. Son fluidos como los líquidos. - Las fuerzas que unen sus partículas son muy débiles. - Las partículas se mueven de forma desordenada con choques entre ellas y con las paredes del recipiente que las contiene. Ejemplos:
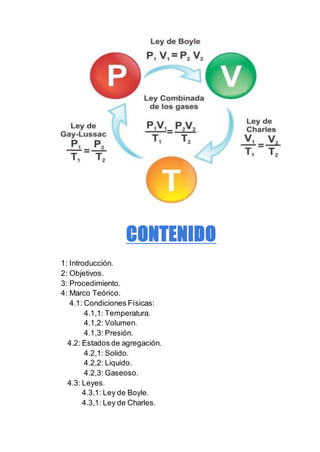
- 13. LEYES DE LOS GASES Ley de Boyle:
- 14. Fue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte. - La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante. Formula: Ley de charles: Es una de las leyes de los gases. Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenida a una presión constante, mediante una constante de proporcionalidad directa. En esta ley, Jacques Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye. 1Esto se debe a que la temperatura está directamente relacionada con la energía cinética debido al movimiento de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas. Volumen sobre temperatura: Constante (K -en referencia a si mismo)
- 15. Formula: Ley de Gay Lussac: A presión constante, el volumen de un gas es directamente proporcional a la temperatura, es lo que indica la Ley de Gay- Lussac. Hay un aumento en la temperatura (mire el tamaño de la llama y en el indicador de temperatura) y un aumento proporcional en el volumen. Como la masa del gas permanece constante, o sea, no hay entrada o salida de gas del interior del cilindro (partículas), la presión también permanece constante. El aumento de volumen es resultado del aumento de la vibración de las moléculas del gas debido a la transferencia de energía. - Si es una gas ideal: P.V=n.R.T. Si la temperatura aumenta y la presión permanece constante, entonces el volumen debe aumentar proporcionalmente. Formula:
- 16. Ley Combinadade los gases: La ley general de los gases o ley combinada dice que una masa de un gas ocupa un volumen que está determinado por la presión y la temperatura de dicho gas. Estudia el comportamiento de una determinada masa de gas si ninguna de esas magnitudes permanece constante. Esta ley se emplea para todos aquellos gases ideales en los que el volumen, la presión y la temperatura no son constantes. Además la masa no varía. La fórmula de dicha ley se expresa: Es decir, el volumen de la situación inicial por la presión original sobre la temperatura es igual a el volumen final por la nueva presión aplicada sobre la temperatura modificada. La presión es una fuerza que se ejerce por la superficie del objeto y que mientras más pequeña sea ésta, mayor presión habrá A partir de la ley combinada podemos calcular la forma como cambia el volumen o presión o temperatura si se conocen las condiciones iniciales (Pi,Vi,Ti) y se conocen dos de las condiciones finales (es decir, dos de las tres cantidades Pt, Vt, Tf). Ley de los gases Ideales:
- 17. La ley de Boyle, la ley de Charles y el principio de Avogadro, son todas afirmaciones de proporcionalidad que describen los gases ideales. Si se combinan estas tres proporciones se obtiene una expresión general que relaciona las cuatro variables, Agregando estas proporciones se obtiene: - Volumen - Temperatura - Presion - Número de moles. - R es una constante válida como la constante universal de los gases ideales. - P es la presión (atm). - T es °K - V son los Litros - n son los Moles. ACTIVIDADES Ley de Charles. ●EJERCICIO.
- 19. ●SOLUCIÓN.
- 21. ●EJERCICIO.
- 28. ●SOLUCIÓN.