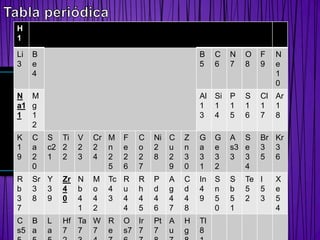
Presentación1 tabla
- 1. H 1 Li B B C N O F N 3 e 5 6 7 8 9 e 4 1 0 N M Al Si P S Cl Ar a1 g 1 1 1 1 1 1 1 1 3 4 5 6 7 8 2 K C S Ti V Cr M F C Ni C Z G G A S Br Kr 1 a c2 2 2 2 n e o 2 u n a e s3 e 3 3 9 2 1 2 3 4 2 2 2 8 2 3 3 3 3 3 5 6 0 5 6 7 9 0 1 2 4 R Sr Y Zr N M Tc R R P A C In S S Te I X b 3 3 4 b o 4 u h d g d 4 n b 5 5 e 3 8 9 0 4 4 3 4 4 4 4 4 9 5 5 2 3 5 7 1 2 4 5 6 7 8 0 1 4 C B L Hf Ta W R O Ir Pt A H Tl s5 a a 7 7 7 e s7 7 7 u g 8
- 2. Primer elemento de la tabla periódica. En condiciones normales es un gas incoloro, inodoro e insípido, compuesto de moléculas diatómicas, H2. El átomo de hidrógeno, símbolo H, consta de un núcleo de unidad de carga positiva y un solo electrón. Tiene número atómico 1 y peso atómico de 1.00797. Read more: http://www.lenntech.es/periodica/ele mentos/h.htm#ixzz1k0TrwuxB
- 3. Elemento químico gaseoso, símbolo He, número atómico 2 y peso atómico de 4.0026. El helio es uno de los gases nobles del grupo O de la tabla periódica. Es el segundo elemento más ligero. La fuente principal de helio del mundo es un grupo de campos de gas natural en los Estados Unidos. El helio es un gas incoloro, inodoro e insípido. Tiene menor solubilidad en agua que cualquier otro gas. Read more: http://www.lenntech.es/periodica/eleme ntos/he.htm#ixzz1k0UQJuYp
- 4. El litio encabeza la familia de los metales alcalinos en la tabla periódica. En la naturaleza se encuentra como una mezcla de los isótopos Li6 y Li7. Es el metal sólido más ligero, es blando, de bajo punto de fusión y reactivo. Muchas propiedades físicas y químicas son tan o más parecidas a las de los metales alcalinotérreos que a las de su grupo. Read more: http://www.lenntech.es/periodica/ele mentos/li.htm#ixzz1k0UvNtWU
- 5. El berilio, metal raro, es uno de los metales estructurales más ligeros, su densidad es cerca de la tercera parte de la del aluminio. El berilio tiene diversas propiedades poco comunes e incluso únicas. Read more: http://www.lenntech.es/periodica/ elementos/be.htm#ixzz1k0VXdJ dI
- 6. • Elemento químico, B, número atómico 5, peso atómico 10.811. Tiene tres elementos de valencia y se comporta como no metal. Se clasifica como metaloide y es el único elemento no metálico con menos de cuatro electrones en la capa externa. El elemento libre se prepara en forma cristalina o amorfa. La forma cristalina es un sólido quebradizo, muy duro Read more: http://www.lenntech.es/periodica/ele mentos/b.htm#ixzz1k0YY45OP
- 7. El carbono es único en la química porque forma un número de compuestos mayor que la suma total de todos los otros elementos combinados. Con mucho, el grupo más grande de estos compuestos es el constituido por carbono e hidrógeno. Se estima que se conoce un mínimo de 1.000.000 de compuestos orgánicos y este número crece rápidamente cada año. Read more: http://www.lenntech.es/periodica/el ementos/c.htm#ixzz1k0ZApkAN
- 8. Elemento químico, símbolo N, número atómico 7, peso atómico 14.0067; es un gas en condiciones normales. El nitrógeno molecular es el principal constituyente de la atmósfera ( 78% por volumen de aire seco). Esta concentración es resultado del balance entre la fijación del nitrógeno atmosférico por acción bacteriana, eléctrica (relámpagos) y química (industrial) y su liberación a través de la descomposición de materias orgánicas por bacterias o por combustión. Read more: http://www.lenntech.es/periodica/eleme ntos/n.htm#ixzz1k17e8BaR
- 9. Elemento químico gaseoso, símbolo O, número atómico 8 y peso atómico 15.9994. Es de gran interés por ser el elemento esencial en los procesos de respiración de la mayor parte de las células vivas y en los procesos de combustión. Read more: http://www.lenntech.es/periodica/ elementos/o.htm#ixzz1k18T5IbQ
- 10. Símbolo F, número atómico 9, miembro de la familia de los halógenos con el número y peso atómicos más bajos. Aunque sólo el isótopo con peso atómico 19 es estable, se han preparado de manera artificial los isótopos radiactivos, con pesos atómicos 17 y 22, el flúor es el elemento más electronegativo, y por un margen importante, el elemento no metálico más energético químicamente. Read more: http://www.lenntech.es/periodica/elem entos/f.htm#ixzz1k198kG2q
- 11. Elemento químico, símbolo Na, número atómico 11 y peso atómico 22.9898. Es un metal suave, reactivo y de bajo punto de fusión, con una densidad relativa de 0.97 a 20ºC (68ºF). Desde el punto de vista comercial, el sodio es el más importante de los metales alcalinos. Read more: http://www.lenntech.es/periodica/ele mentos/na.htm#ixzz1k19sK1M5
- 12. Elemento químico, metálico, de símbolo Mg, colocado en el grupo IIa del sistema periódico, de número atómico 12, peso atómico 24.312. El magnesio es blanco plateado y muy ligero. Su densidad relativa es de 1.74 y su densidad de 1740 kg/m3 (0.063 lb/in3) o 108.6 lb/ft3). Read more: http://www.lenntech.es/periodic a/elementos/mg.htm#ixzz1k1A NZdgj
- 13. • Elemento químico metálico, de símbolo Al, número atómico 13, peso atómico 26.9815, que pertenece al grupo IIIA del sistema periódico. El aluminio puro es blando y tiene poca resistencia mecánica, pero puede formar aleaciones con otros elementos para aumentar su resistencia y adquirir varias propiedades útiles. Read more: http://www.lenntech.es/periodica/e lementos/al.htm#ixzz1k0Wwe0FS
- 14. Símbolo Si, número atómico 14 y peso atómico 28.086. El silicio es el elemento electropositivo más abundante de la corteza terrestre. Es un metaloide con marcado lustre metálico y sumamente quebradizo. Por lo regular, es tetravalente en sus compuestos, aunque algunas veces es divalente, y es netamente electropositivo en su comportamiento químico. Read more: http://www.lenntech.es/periodica/elem entos/si.htm#ixzz1k1Ayl6yh
- 15. Símbolo P, número atómico 15, peso atómico 30.9738. El fósforo forma la base de gran número de compuestos, de los cuales los más importantes son los fosfatos. Read more: http://www.lennte ch.es/periodica/elemen tos/p.htm#ixzz1kItklO0
- 16. Elemento químico, S, de número atómico 16. Los isótopos estables conocidos y sus porcentajes aproximados de abundancia en el azufre natural son éstos: 32S (95.1%); 33S (0.74%); 34S (4.2%) y 36S (0.016%). Read more: http://www.lenntech .es/periodica/elementos/s. htm#ixzz1kIuF49EB
- 17. Elemento químico, símbolo Cl, de número atómico 17 y peso atómico 35.453. El cloro existe como un gas amarillo-verdoso a temperaturas y presiones ordinarias. Read more: http://www.lenntech.es /periodica/elementos/cl.htm# ixzz1kIuqgi5Y
- 18. Elemento químico con símbolo Ar, número atómico 15 y peso atómico 39.948. El argón es el tercer miembro del grupo 0 en la tabla periódica. Los elementos gaseosos de este grupo se llaman gases nobles, inertes o raros, aunque en realidad el argón no es raro. Read more: http://www.lenntech.es/per iodica/elementos/ar.htm#ixzz1kI vOfewl
- 19. Elemento químico, símbolo K, número atómico 19 y peso atómico 39.098. Ocupa un lugar intermedio dentro de la familia de los metales alcalinos después del sodio y antes del rubidio. Read more: http://www.lenntech.es /periodica/elementos/k.htm#i xzz1kIwxLfbX
- 20. Elemento químico, Ca, de número atómico 20; es el quinto elemento y el tercer metal más abundante en la corteza terrestre. Los compuestos de calcio constituyen 3.64% de la corteza terrestre. El metal es trimorfo, más duro que el sodio, pero más blando que el aluminio. Read more: http://www.lenntech.es/p eriodica/elementos/ca.htm#ixzz 1kIvvKFS2
- 21. Elemento químico, símbolo Sc, número atómico 21 y peso atómico 44.956. Es el primer elemento de transición del primer periodo largo. Los isótopos del escandio son 40Sc y 51 Sc y uno correspondiente a cada valor intermedio. Read more: http://www.lenntech.es /periodica/elementos/sc.htm #ixzz1kIxGHnmC
- 22. Elemento químico, Ti, de número atómico 22 y peso atómico 47.90. Mientras que su comportamiento químico muestra muchas semejanzas con el del silicio y el zirconio, como un elemento del primer grupo de transición, la química de la solución acuosa, especialmente de los estados de oxidación más bajos, tiene algunas semejanzas con la del cromo y el vanadio. Read more: http://www.lenntech.es/perio dica/elementos/ti.htm#ixzz1kIxZHk LJ
- 23. Elemento químico de símbolo V, número atómico 23, peso atómico 50.942. Es un metal que se utilizó inicialmente en aleaciones con hierro y acero. Varios de los compuestos de vanadio se emplean en la industria química, sobre todo en la fabricación de catalizadores de oxidación, y en la industria cerámica como agentes colorantes. Read more: http://www.lenntech.es/p eriodica/elementos/v.htm#ixzz1 kIxuSyaA
- 24. • Elemento químico, símbolo Cr, número atómico 24, peso atómico 51.996; metal que es de color blanco plateado, duro y quebradizo. Sin embargo, es relativamente suave y dúctil cuando no está tensionado o cuando está muy puro. Read more: http://www.lenntech.es/ periodica/elementos/cr.htm#ix zz1kIyNhM3V
- 25. Elemento químico, símbolo Mn, de número atómico 25 y peso atómico 54.938. Es uno de los metales de transición del primer periodo largo de la tabla periódica; se encuentra entre el cromo y el hierro. Read more: http://www.lenntech.es /periodica/elementos/mn.htm #ixzz1kIyf3GWN