Sustitucion nucleofilica al_grupo_carbonilo[1]
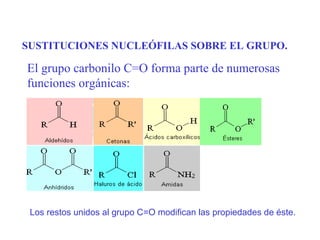
- 1. SUSTITUCIONES NUCLEÓFILAS SOBRE EL GRUPO. El grupo carbonilo C=O forma parte de numerosas funciones orgánicas: Los restos unidos al grupo C=O modifican las propiedades de éste.
- 2. Los ácidos carboxílicos son los productos de descomposición oxidativa de materiales orgánicos; algunos ésteres son componentes de aromas de frutas y las amidas constituyen el esqueleto de la estructura proteica. Otros dos importantes miembros de este grupo, los halogenuros de acilo y los anhídridos, no se encuentran en la naturaleza. El grupo carbonilo es nuevamente la clave de la química de los derivados de los ácidos carboxílicos. Los derivados de ácidos carboxílicos contienen grupos salientes unidos al grupo carbonilo, mientras que los aldehídos y cetonas no los tienen.
- 3. O OH ROH CH3CCH3 CH3 C CH3 adición RO O O H2O CH3C Cl CH3C OH + HCl Sustitución Reactividad de los derivados de ácidos carboxílicos Haluros de ácido > Anhidridos > Esteres > Amidas > Acidos carboxílicos
- 4. Las reacciones de ácidos carboxílicos y derivados tienen lugar mediante un proceso de sustitución por adición-eliminación. Donde X puede ser:
- 5. La consecuencia de este proceso es la formación de un nuevo compuesto mediante un proceso que ha conservado el grupo carbonilo. Grupo Saliente La sustitución nucleofílica sobre un grupo carbonilo requiere la pérdida de un grupo diferente al nucleófilo que entra. El grupo saliente (X) parte con el par electrónico mediante el cual se encontraba unido originalmente al grupo carbonilo. Se debe considerar: Las bases débiles son buenos grupos salientes, ya que pueden acomodar eficazmente el par electrónico. Por lo tanto, cuando más estable es el grupo saliente, mayor es la reactividad del derivado carboxílico frente a un nucleófilo.
- 6. Halogenuros de acilo y anhídridos Los halogenuros de acilo y los anhídridos son los más reactivos de los derivados de los ácidos carboxílicos. Los halogenuros y los carboxilatos son buenos grupos salientes. Ambos son aniones relativamente estables: O O - - X R C + Nu R C + X Nu O O O O - R C C R + Nu R C + R C - O Nu O Los halogenuros son más reactivos que los anhídridos (grupo saliente).
- 7. Preparación de halogenuros de acilo: Los fluoruros, cloruros, bromuros y yoduros de ácido reaccionan de manera similar. Pero, los cloruros son los más populares de los halogenuros de ácido. Los cloruros de acilo se preparan normalmente a partir de ácidos carboxílicos por reacción de cloruro de tionilo (SOCl2) o halogenuros de fósforo (PCl3 o PCl5). O O CH3C + SOCl2 CH3C + SO2 + HCl OH Cl Acido acético cloruro de tionilo Cloruro de acetilo (cloruro de etanoílo) Cualquiera de estos reactivos convierte en primer lugar el grupo hidroxilo del ácido carboxílico en un derivado que puede considerarse como un anhídrido mixto orgánico-inorgánico.
- 8. El átomo de oxígeno del grupo hidroxilo se incorpora a un buen grupo saliente. O O O R C + SOCl2 R C S Cl + HCl OH O - O O O O O - - R C O S R C + SO 2 + Cl Cl + R C S Cl O Cl Cl Cl Experimentalmente, se adiciona el ácido carboxílico sobre un exceso de cloruro de tionilo, se aguarda hasta el fin de la evolución de los productos gaseosos (SO2 y HCl) y se elimina por destilación el exceso de reactivo.
- 9. Preparación de anhídridos de ácido Los anhídridos de ácido no se pueden formar directamente de los ácidos carboxílicos, sino que deben prepararse a partir de derivados de ácidos carboxílicos. Una ruta es la utilización de un cloruro de ácido con un carboxilato. O O O O - - R C Cl + OCR` RC OCR` + Cl cloruro de acilo carboxilato un anhídrido A menudo se utiliza piridina como base para aumentar la nucleofilia del ácido carboxílico y para reaccionar con HCl que se forma.
- 10. La deshidratación es otro método para la preparación de anhídridos, debido a que estos compuestos constan formalmente de dos moléculas de ácido carboxílico en las que se ha eliminado una molécula de agua. Se utiliza como agente deshidratante un anhídrido, ya que estos compuestos reaccionan fácilmente con agua (anhídrido acético) 2 C6H5CO 2H + (CH3CO)2O (C6H5CO)2O + 2 CH3CO2H ácido anhídrido anhídrido ácido acético benzoico acético benzoico El producto de hidrólisis, el ácido acético, posee un punto de ebullición inferior a la de la mayoría de los ácidos carboxílicos. Por lo tanto, el equilibrio de la reacción se desplaza destilando el ácido acético.
- 11. Oxígeno como nucleófilo Las interconversiones de ésteres y ácidos carboxílicos, transcurren en direcciones opuestas. Son sustituciones nucleofílicas por parte de nucleófilos oxigenados sobre el grupo carbonilo. La esterificación de un ácido carboxílico implica la sustitución del hidroxilo por un grupo alcóxido. O O RC + R` OH RC + H2O OH OR` ácido carboxílico Ester
- 12. A. Sustitución por alcoholes: La reacción de un ácido carboxílico con un alcohol en presencia de un catalizador ácido es un método habitual en la preparación de ésteres. La reacción se conoce como esterificación de Fischer. Los ésteres volátiles dan aromas agradables a muchos frutos y perfumes. Las grasas y aceites son ésteres. + H CH3CO2H + C2H5OH CH3CO2C2H5 + H2O K= 4 ácido acético etanol acetato de etilo Las constantes de equilibrio para la esterificación son pequeñas. ¿Métodos para aumentar la cantidad de éster?
- 13. Mecanismo de reacción (resumido): la esterificación de un ácido carboxílico transcurre a través de una serie de pasos de protonación y desprotonación. (impedimento estérico en el intermediario; reactividad) O + OH O H RCOH + R` OH R C OH RCOR` + H2O ácido carboxílico R` éster intermediario Otros métodos de preparación: 1. A partir de halogenuros de ácido y alcoholes. 2. A partir de un anhídrido y un alcohol. 3. A partir de un carboxilato y un halogenuro de alquilo.
- 14. B. Sustitución por agua: Todos los derivados de los ácidos carboxílicos se hidrolizan (son descompuestos por el agua) conduciendo a ácidos carboxílicos. Los halogenuros de acilo y anhídridos de bajo peso molecular reaccionan violentamente. O CH3C + H2O CH3CO2H + HCl Cl cloruro de acetilo ácido acético O + O H calor COCH3 + H2O COH + CH3OH benzoato de metilo ácido benzoico metanol
- 15. Hidrólisis ácida: El oxígeno carbonílico de un éster se puede protonar. Por lo tanto, el carbono parcialmente positivo puede ser atacado por un nucleófilo débil (agua). + O + OH OH H R C OR R C OR R C OR + - Nu catión estabilizado por resonancia
- 16. Hidrólisis básica: La hidrólisis básica de un éster con una base (saponificación), es una reacción irreversible. Puesto que es irreversible, la saponificación da con frecuencia mejores rendimientos de ácido carboxílico y alcohol que la hidrólisis ácida. O O - - COCH3 + OH CO + CH3OH benzoato de metilo ion benzoato O O - + CO + H COH ácido benzoico Saponificación: del latín “saponis” (jabón)
- 17. Las velocidades de hidrólisis de los ésteres se ven incrementadas tanto por la presencia de ácido como de base, pero existe una gran diferencia. El ácido es un catalizador (se regenera), mientras que la base es un reactivo (se consume). Además que la hidrólisis catalizada por ácido es una reacción de equilibrio con una constante muy baja.
- 18. Nitrógeno como nucleófilo: Las aminas primarias y secundarias, así como el amonico, pueden reaccionar con ácidos carboxílicos y sus derivados con formación de amidas. O O R C + NH R C + HL L N
- 19. Las aminas son bases y reaccionan fácilmente con los ácidos carboxílicos en reacciones ácidos-bases que conducen a sales amónicas (deshidratación). - + 150°C CH3CO2H + NH3 CH3CO2 NH4 CH3CONH2 - H2O ácido acético amoniaco acetamida El método más común para la preparación de amidas es la reacción de halogenuros de acilo con amoniaco o aminas. Se utiliza un exceso para captar el ácido que se forma. H2O + - (CH3)2CHCOCl + NH3 (CH3)2CHCONH2 + NH4 Cl cloruro de acilo exceso 2-metilpropanamida También se utiliza la reacción de ésteres con aminas.
- 20. Hidruros como nucleófilos: Los halogenuros de acilo, anhídridos, ésteres y ácidos carboxílicos tienden a experimentar reducción a alcoholes primarios en presencia de hidruros. Las reacciones de halogenuros de acilo, anhídridos, ésteres y ácidos carboxílicos con hidruros (LiAlH4) son similares y conducen a un alcohol primario O Et2O 2 Cl3CC + LiAlH4 2 Cl3CCH2OH + Cl H3O 2,2,2-tricloroetanol cloruro de tricloroacetilo
- 21. Et2O (C6H5CO)2O + LiAlH4 2 C6H5CH2OH + H3O anhídrido alcohol bencílico benzoico Este tipo de reacción transcurre en dos etapas: - Sustitución con el hidruro como nucleófilo - El producto de la primera reacción es un aldehído o complejo de aldehído el cual reacciona con un hidruro adiconal (paso rápido) conduciendo al producto final. + RCO2H + LiAlH4 R CO2AlH3Li + H2 + + H3O R CO2AlH3Li RCH2OH 28/05/12 Profesor Carlos Urzúa Stricker 21
- 22. Otros hidruros: El borohidruro sódico es un dador de hidruro relativamente débil. Reacciona solamente con los derivados más reactivos: halogenuros de acilo dioxano CH3CH2CH2COCl + NaBH4 CH2CH2CH2CH2OH H2O cloruro de butanoilo 1-butanol
- 23. La reacción de una amida con hidruro de litio y aluminio produce una amina. El proceso es distinto a los otros derivados ya que se pierde el átomo de oxígeno carbonílico. O LiAlH4/Et2O CH3(CH2)10C CH3(CH2)10CH2NHCH3 H2O NHCH3 N-metildodecanamina N-metildodecanamida El mecanismo detallado de la reducción de amidas no es claro. Un mecanismo explica la adición de hidruro al átomo de carbono carbonílico y a continuación la pérdida del átomo de oxígeno en forma de óxido de aluminio.
- 24. Carbono como nucleófilo. Reactivos organometálicos Reacciones de reactivos organometálicos con derivados de ácidos carboxílicos. El curso de la reacción puede ser la sustitución sobre el grupo carbonílo o la sustitución seguida de adición. O R C R` O R C + R`M L OH R C R` R`
- 25. Ésteres: En la reacción se consumen dos moles del reactivo organometálico, obteniéndose un alcohol terciario que contiene dos sustituyentes idénticos. OH Et2O C6H5CO2C2H5 + C6H5MgBr C6H5 C C6H5 + H3O benzoato de etilo C6H5 trifenilmetanol Halogenuros de acilo: Los reactivos organocádmicos son menos reactivos que los compuestos de litio y magnesio. Por lo tanto, reaccionan con los cloruros de acilo obteniéndose una cetona. O C6H6 C6H5COCl + (CH3CH2)2Cd C6H5CCH2CH3 cloruro de dietilcadmio 1-fenil-1-propanona benzoilo
- 26. Ácidos carboxílicos: Las reacciones de los ácidos carboxílicos con reactivos organometálicos conducen rápidamente a sales de ácido carboxílico. Cuando se tratan con un reactivo organolíticos se adicionan al carboxilato, obteniéndose una cetona como producto. - + R`Li + RCO 2H RCO 2 Li + RH - + O O Li + OH - - + H3O H2O RCO 2 Li + R`Li R C R` R C R` R C R` - + O Li OH
- 27. Acilación de aniones enolato. Reacción de Claisen En estas reacciones intervienen aniones enolato actuando como nucleófilos que se adicionan a grupos carbonilo. Estas transformaciones se conocen como reacciones de Claisen. - .. O C C O O O - R C + R C C C + L L - O C C
- 28. Cuando un éster que posee átomos de hidrógeno en posición α se trata con una base fuerte se forma un β -cetoéster. El producto se origina de la combinación de dos moléculas de éster (reacción de Claisen). O NaOEt CH3CCH2CO2C2H5 + C2H5OH 2 CH2CO2C2H5 + H3O acetato de etilo 3-oxobutanoato de etilo Proceso de condensación al igual que la reacción aldólica. Se libera una molécula pequeña (un alcohol).