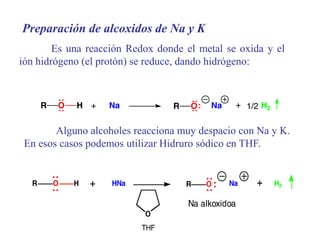
Este documento trata sobre los alcoholes. Explica que son compuestos que contienen el grupo hidroxilo (-OH) y que existen diferentes tipos como el etanol, metanol e isopropanol. También describe la estructura, propiedades físicas, solubilidad, importancia comercial y métodos de síntesis de los alcoholes.