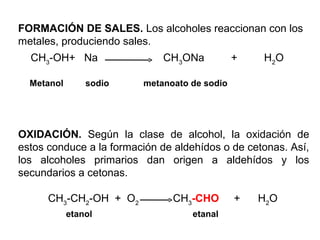
Este documento describe las propiedades y clasificación de los alcoholes. Los alcoholes son compuestos orgánicos derivados de los hidrocarburos donde uno o más átomos de hidrógeno están sustituidos por grupos hidroxilo. Se clasifican como alcoholes primarios, secundarios o terciarios dependiendo del átomo de carbono al que esté unido el grupo hidroxilo. Algunos alcoholes comunes son el metanol, etanol, propanol y butanol, los cuales tienen diversas aplicaciones industriales como combustibles, solventes y