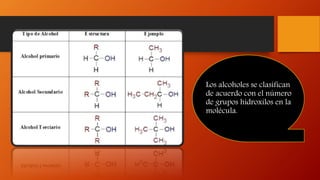
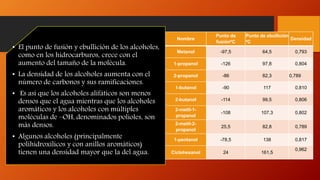
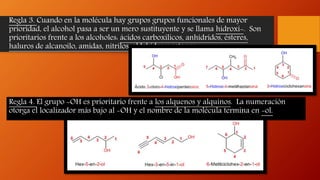
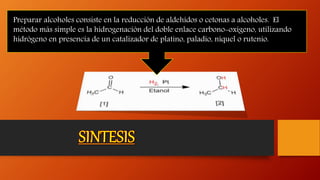
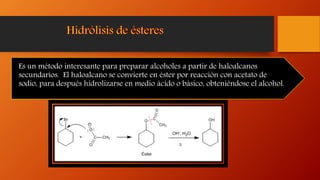
Los alcoholes son compuestos orgánicos que contienen el grupo funcional hidroxilo (-OH). Pueden ser alifáticos o aromáticos. Se clasifican según el número de grupos hidroxilo en la molécula y sus propiedades físicas como punto de fusión y ebullición dependen del tamaño molecular. Reaccionan de diferentes formas reteniendo u oxidando el oxígeno.