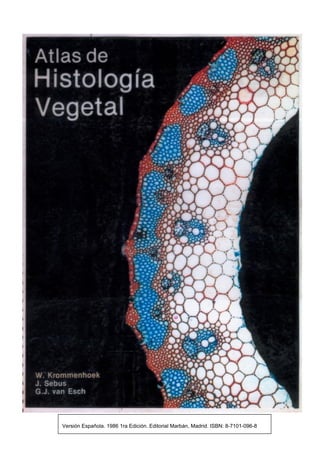
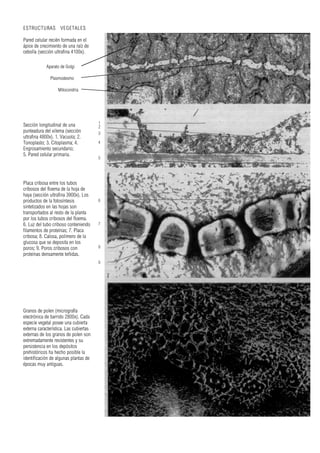
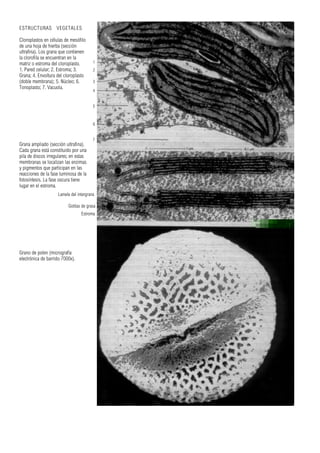
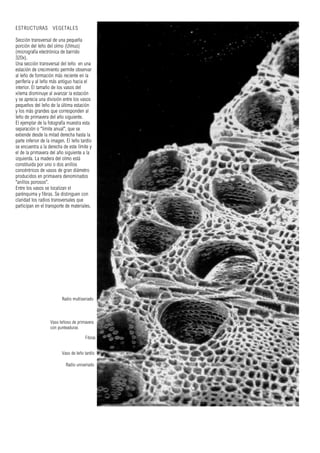
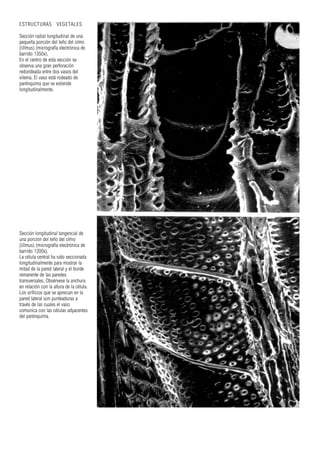
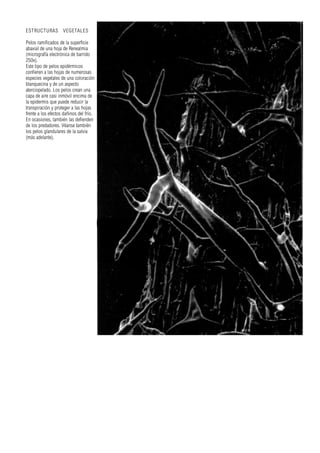
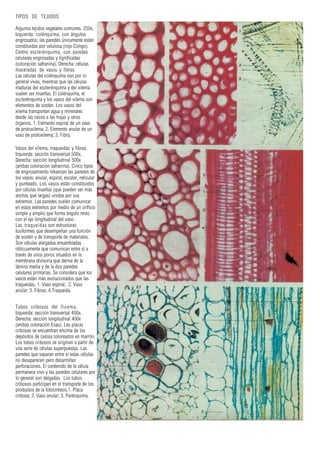
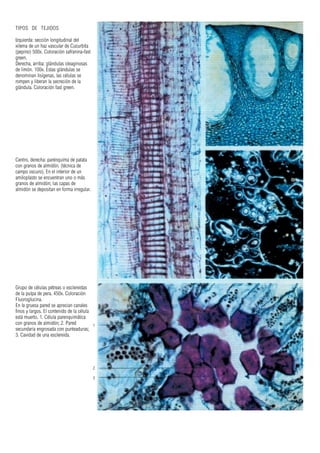
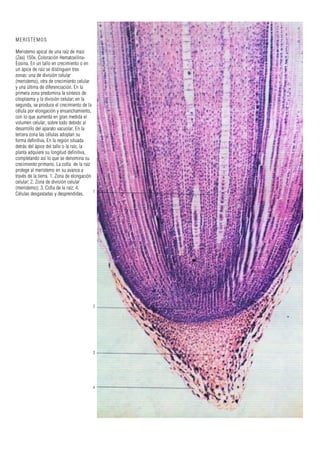
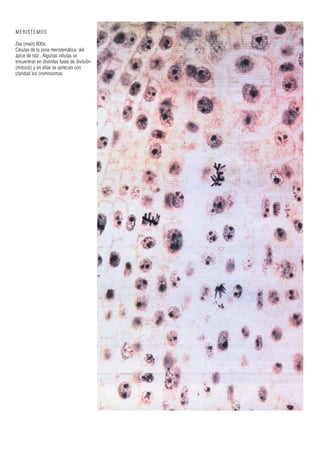
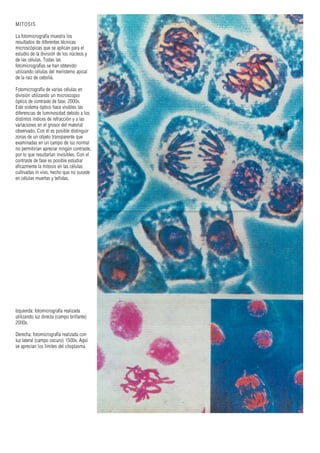
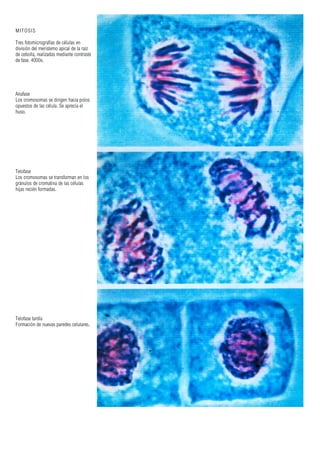
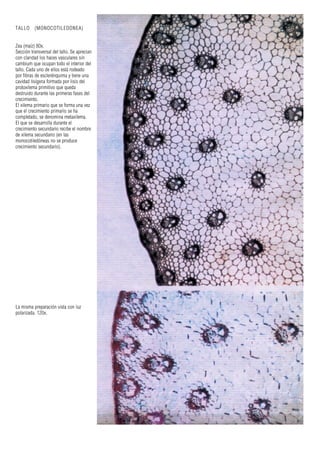
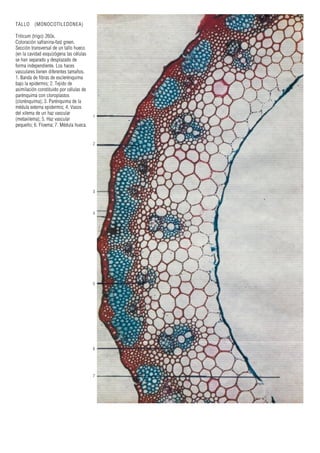
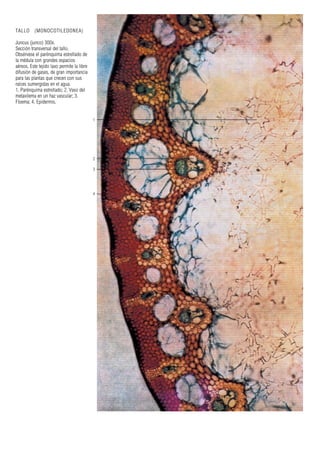
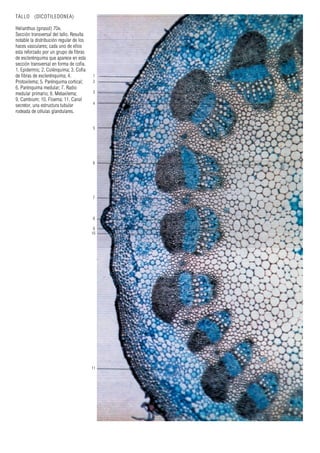
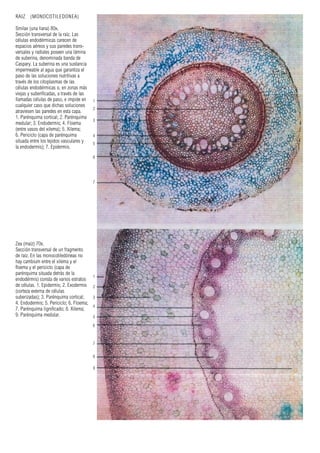
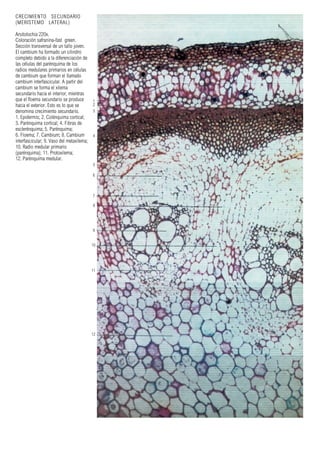
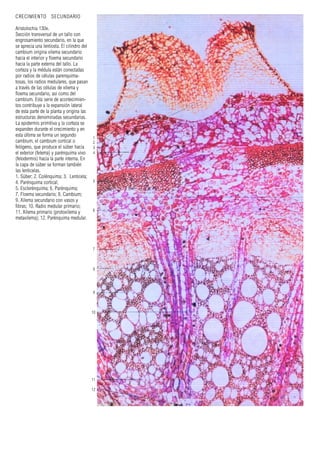
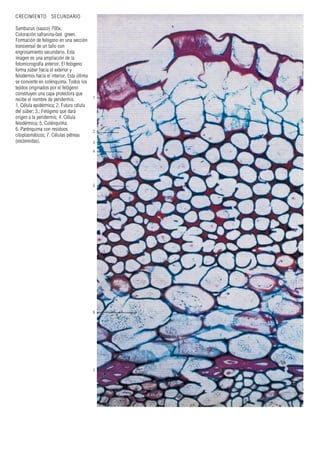
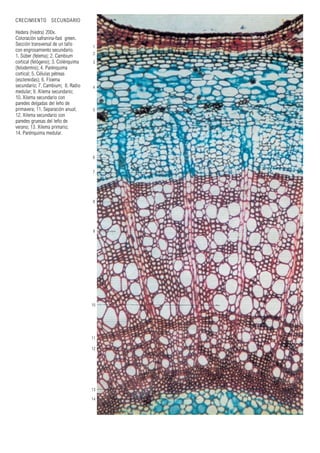
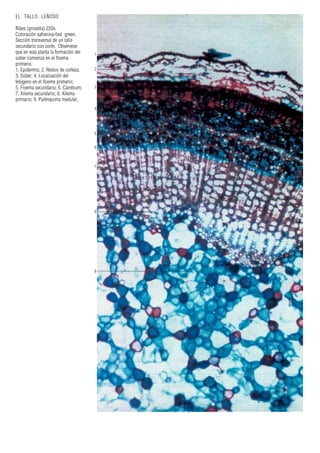
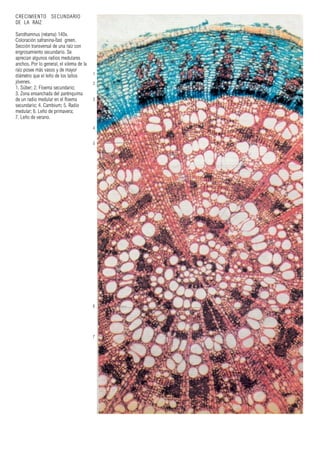
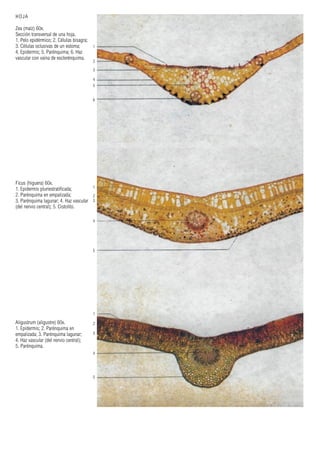
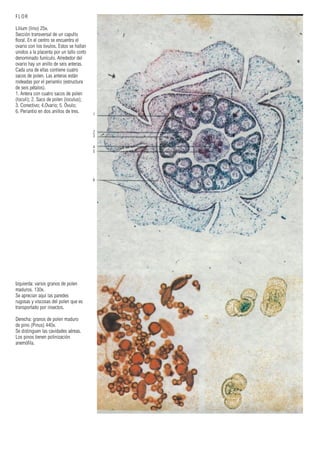
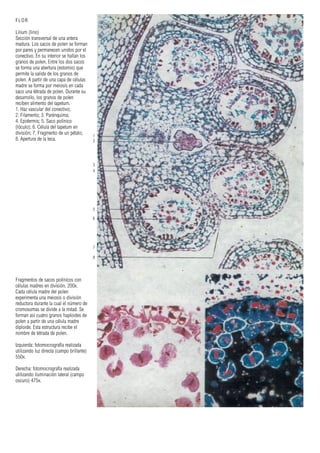
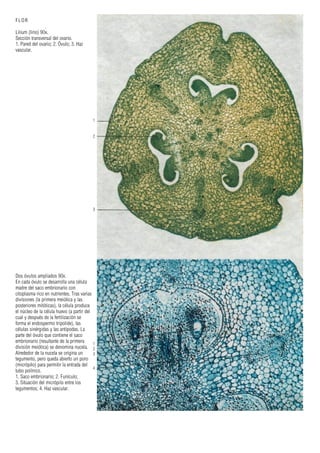
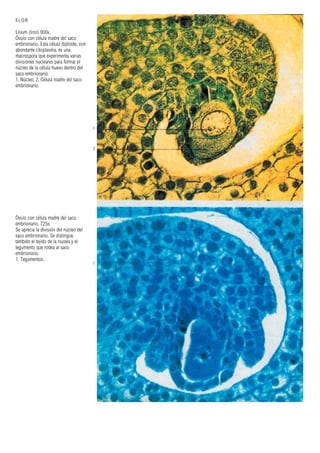
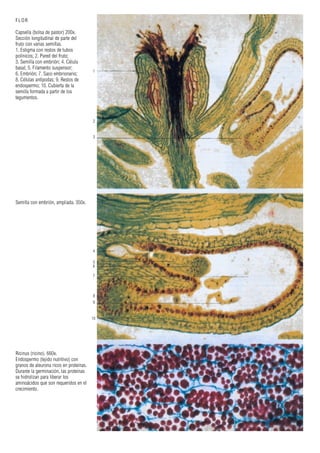
Este documento presenta varias imágenes microscópicas de estructuras vegetales como paredes celulares, punteaduras, cloroplastos, granos de polen, tejidos como xilema, floema y clorénquima. También incluye imágenes de meristemas apicales mostrando división celular, y fases de la mitosis en células de cebolla. Finalmente muestra secciones transversales de tallos de maíz y trigo con detalles de los haces vasculares.