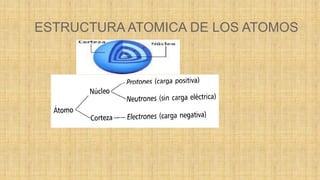
El documento describe la estructura atómica de los átomos. Explica que los átomos están formados por electrones que giran alrededor de un núcleo central compuesto de protones y neutrones. Los electrones se agrupan en capas electrónicas y los enlaces químicos entre átomos se producen cuando los electrones se comparten o transfieren entre los átomos. Hay tres tipos principales de enlaces químicos: enlaces iónicos, enlaces metálicos y enlaces covalentes. Además, existen