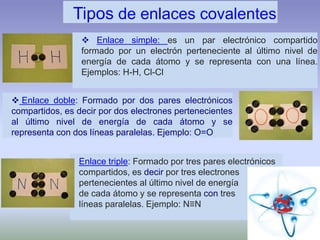
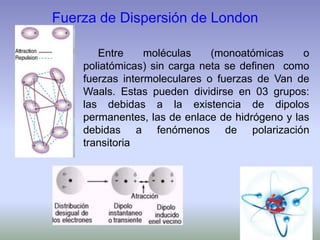
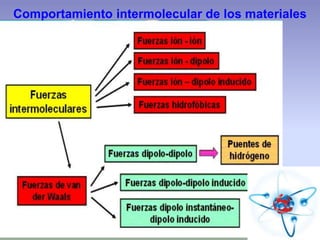
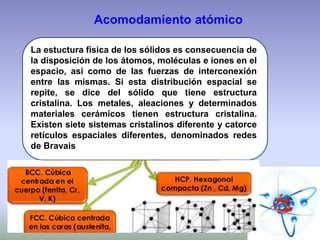
El documento describe la estructura atómica de los materiales. Explica que los átomos están compuestos de protones, neutrones y electrones y que las interacciones entre estos determinan las propiedades de los materiales. También describe los diferentes tipos de enlaces entre átomos, incluyendo enlaces iónicos, covalentes y metálicos, así como las fuerzas intermoleculares que mantienen unidos los átomos dentro de los materiales.