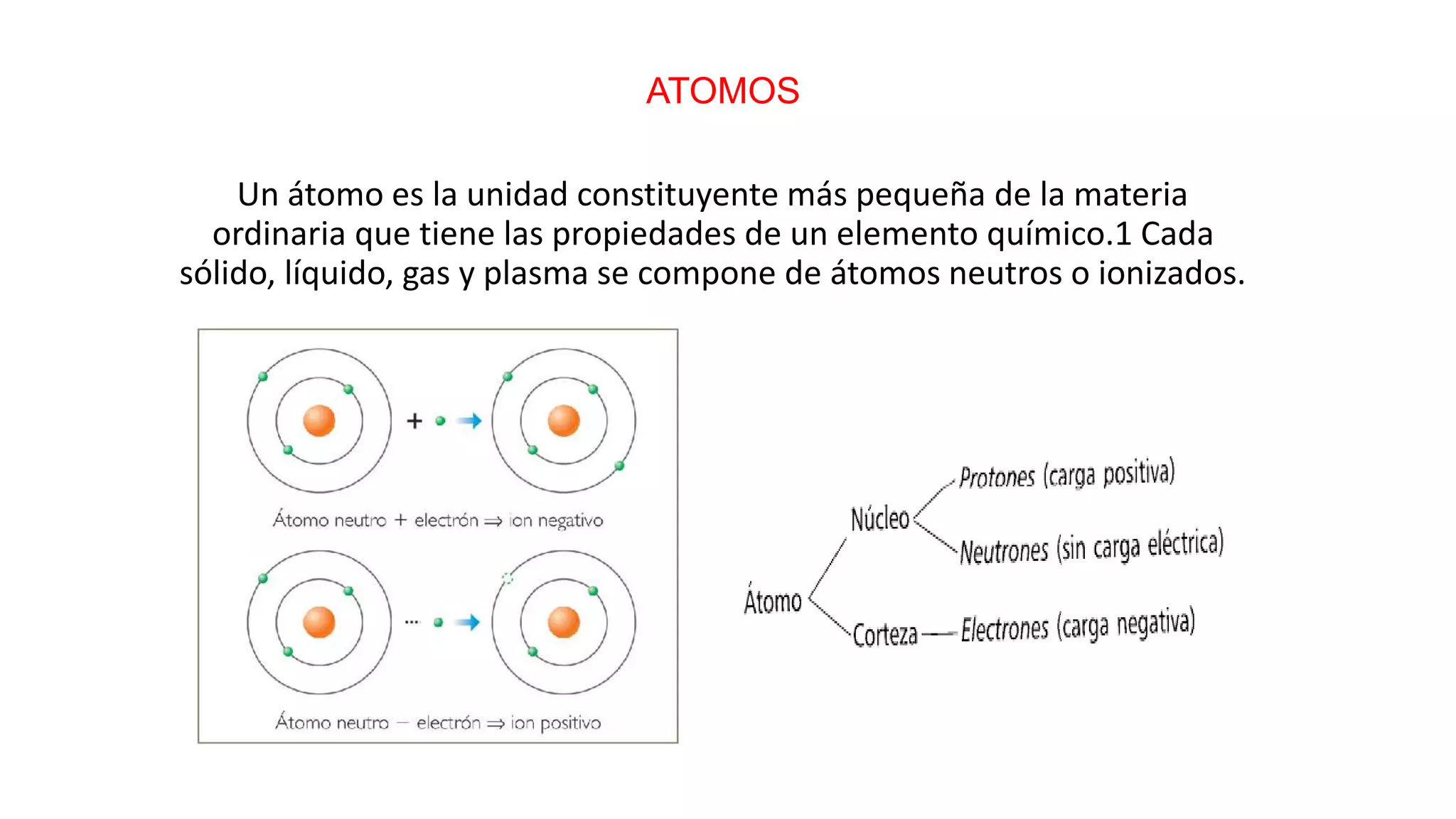
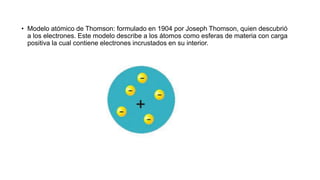
Un átomo es la unidad más pequeña de la materia que tiene las propiedades de un elemento químico. Los átomos son muy pequeños, alrededor de 100 pm de tamaño, y están compuestos de un núcleo central rodeado de electrones. Se han propuesto varios modelos atómicos a lo largo de la historia, incluyendo los modelos de Dalton, Thomson, Rutherford, Bohr y Sommerfeld.