1) Un átomo es la unidad constituyente más pequeña de la materia y está compuesto de un núcleo central rodeado de electrones.
2) El núcleo contiene protones y neutrones, mientras que los electrones se mueven alrededor del núcleo en diferentes niveles de energía.
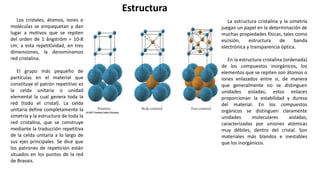
3) Los átomos se pueden unir para formar estructuras cristalinas ordenadas mediante enlaces químicos, dando lugar a sustancias como los sólidos, líquidos y gases.