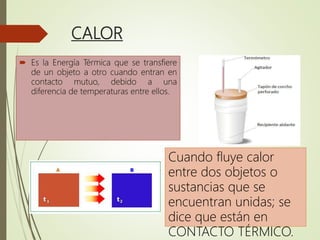
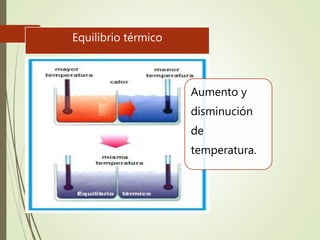
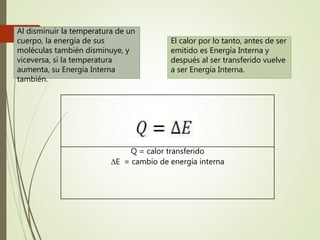
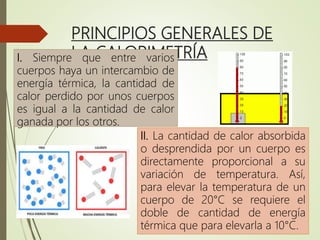
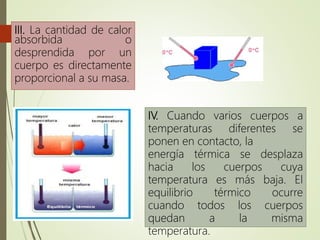
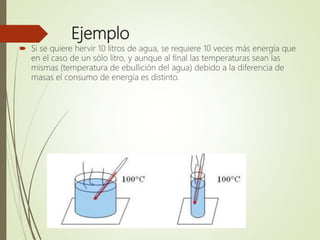
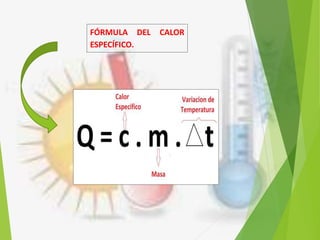
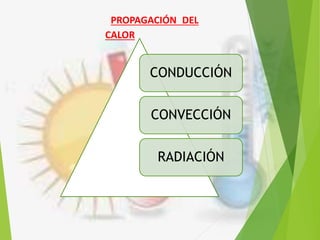
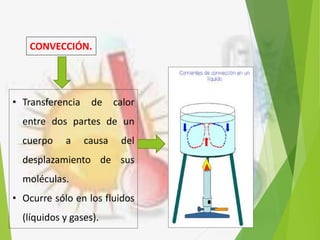
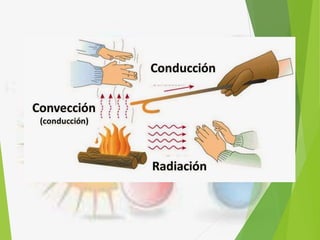
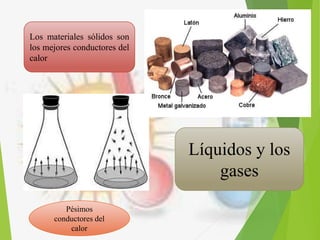
El documento trata sobre la calorimetría y la transferencia del calor. Explica que la calorimetría mide la cantidad de calor involucrado en procesos físicos y químicos. Describe los tres métodos de transferencia de calor: conducción, convección y radiación. También define conceptos clave como el calor específico y la conductividad térmica, y presenta fórmulas para calcular la cantidad de calor transferido.