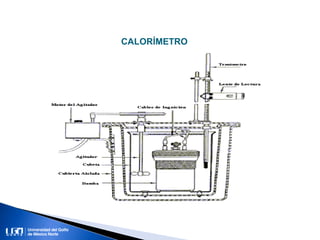
Este documento introduce conceptos clave sobre calor y temperatura. Explica que calor y temperatura son diferentes, y describe estados de la materia, tipos de calor como sensible y latente, formas de propagación del calor, y conceptos como capacidad y calor específico. El objetivo es ayudar a los estudiantes a distinguir entre calor y temperatura y entender mejor la termodinámica.