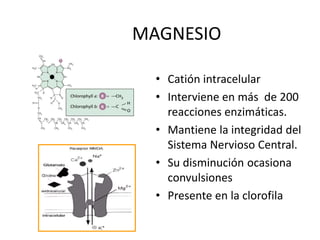
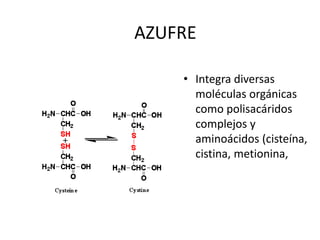
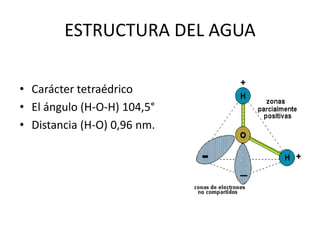
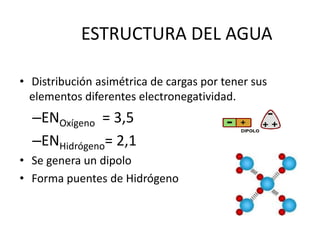
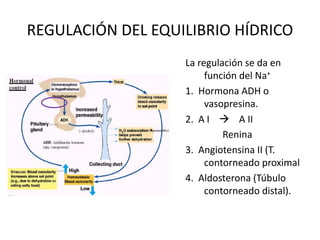
Este documento presenta una introducción a la bioquímica. Explica que la bioquímica estudia los seres vivos y las sustancias químicas y reacciones químicas involucradas. Luego describe los principales bioelementos que componen los seres vivos, incluidos los bioelementos primarios como el carbono, hidrógeno, oxígeno y nitrógeno. Finalmente, se enfoca en el agua, la molécula más abundante en los seres vivos y sus propiedades y funciones importantes como disolvente universal y ter