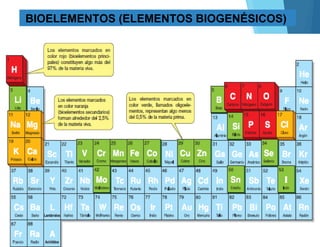
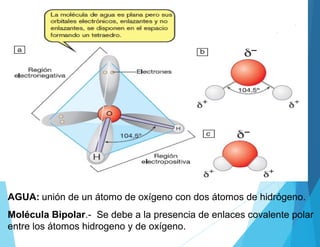
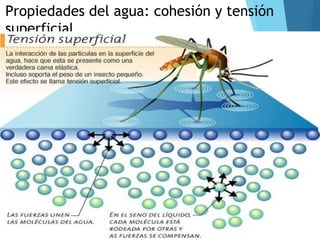
Este documento describe los elementos esenciales que forman la materia viva, incluyendo bioelementos primarios como carbono, hidrógeno, oxígeno, nitrógeno, fósforo y azufre; bioelementos secundarios como sodio, potasio, calcio y magnesio; y oligoelementos como hierro, cobre y zinc. También explica las funciones del agua y las sales minerales en los seres vivos.