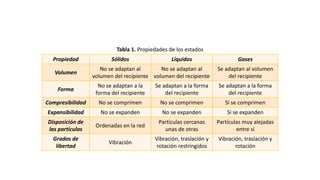
Este documento presenta la unidad 1 de Química I sobre el estado líquido y soluciones. Se define el estado líquido y sus características principales como menor desorden que los gases pero mayor cohesión que los sólidos. También introduce conceptos básicos sobre soluciones como su definición, clasificación, solubilidad, unidades de concentración y propiedades como la disminución de la presión de vapor y fenómenos como la ebulloscopía, crioscopía y presión osmótica.