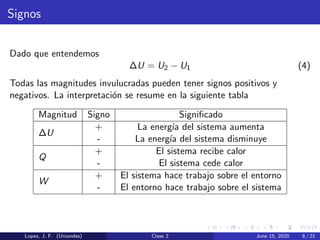
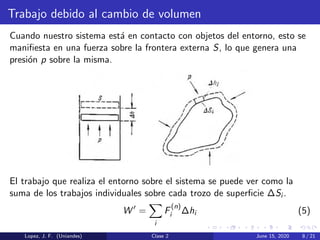
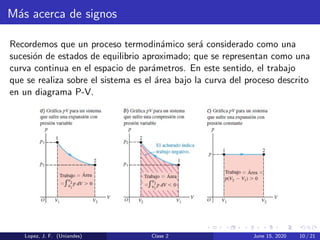
Este documento presenta la primera ley de la termodinámica y diferentes procesos termodinámicos. Explica conceptos como la energía interna de un sistema, el trabajo realizado por un cambio de volumen, y la relación entre el cambio de energía interna, el calor transferido y el trabajo. También describe procesos como isocórico, isobárico e isotérmico, y aplica los conceptos a un ejemplo numérico.