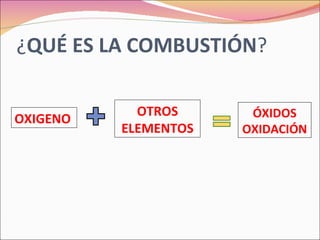
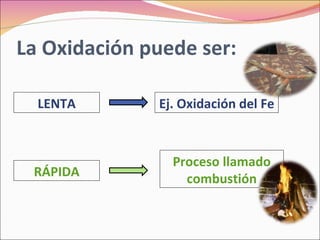
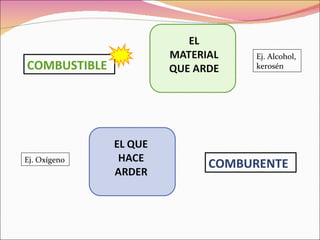
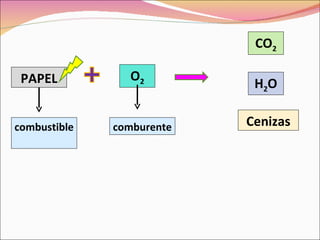
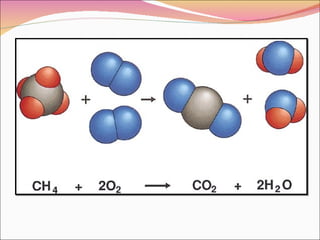
La combustión es una reacción química entre un combustible y el oxígeno que libera energía en forma de calor y luz. Puede ser completa o incompleta dependiendo de si el combustible reacciona completamente o no. Requiere tres factores: combustible, comburente (normalmente oxígeno), e ignición.