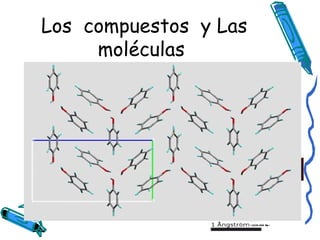
Este documento describe las diferentes formas de representar la estructura molecular de compuestos y moléculas, incluyendo fórmulas químicas, fórmulas estructurales y modelos tridimensionales. También explica que las moléculas son agrupaciones estables de átomos unidos por enlaces covalentes, y que los compuestos químicos resultan de la unión de dos o más elementos en proporciones fijas.