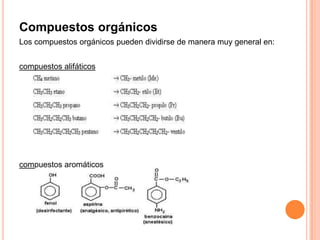
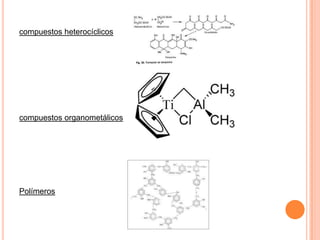
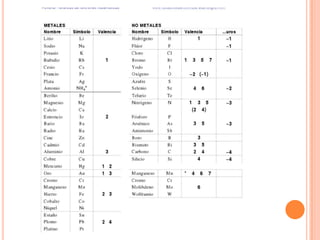
Este documento presenta información sobre química general para una escuela de enfermería. Explica conceptos fundamentales como los estados de la materia (sólido, líquido, gaseoso y plasmático), compuestos químicos, mezclas, leyes ponderales, elementos químicos, fórmulas químicas, compuestos inorgánicos y orgánicos, grupos y períodos de la tabla periódica, valencia y número de oxidación. También incluye ejemplos de óxidos básicos y ácid