Cuadro comparativo
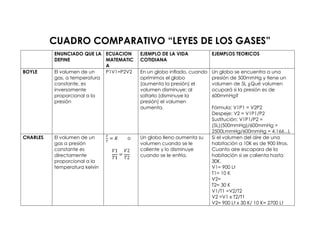
- 1. CUADRO COMPARATIVO “LEYES DE LOS GASES” ENUNCIADO QUE LA DEFINE ECUACION MATEMATIC A EJEMPLO DE LA VIDA COTIDIANA EJEMPLOS TEORICOS BOYLE El volumen de un gas, a temperatura constante, es inversamente proporcional a la presión P1V1=P2V2 En un globo inflado, cuando oprimimos el globo (aumenta la presión) el volumen disminuye; al soltarlo (disminuye la presión) el volumen aumenta. Un globo se encuentra a una presión de 500mmHg y tiene un volumen de 5L ¿Qué volumen ocupará si la presión es de 600mmHg? Fórmula: V1P1 = V2P2 Despeje: V2 = V1P1/P2 Sustitución: V1P1/P2 = (5L)(500mmHg)/600mmHg = 2500LmmHg/600mmHg = 4.166...L CHARLES El volumen de un gas a presión constante es directamente proporcional a la temperatura kelvin o Un globo lleno aumenta su volumen cuando se le caliente y lo disminuye cuando se le enfría. Si el volumen del aire de una habitación a 10K es de 900 litros. Cuanto aire escapara de la habitación si se calienta hasta 30K. V1= 900 Lt T1= 10 K V2= T2= 30 K V1/T1 =V2/T2 V2 =V1 x T2/T1 V2= 900 Lt x 30 K/ 10 K= 2700 Lt
- 2. GAY LUSSAC A volumen constante , la presión de un gas es directamente proporcional a la temperatura o La puedes observar en las ollas a presión (el volumen es constante. Si calientas la olla, el gas en su interior aumenta su presión. Un gas está en un recipiente de 25 L a 25°C y 480 mmHg. ¿ A qué temperatura en °C llegará el gas si aumenta la presión interna hasta 1.12 ATM? P1 = 480/760 = 0,632 atm T1 = 273 + 25 = 298º K P2 = 1,12 atm 0,632/298 = 1,12/T2 T2 = 1,12*298/0,632 = 528,1º K 528,1 - 273 = 255,1º K LEY COMBINAD A DE LOS GASES Es una ley de los gases que combinada ley de Boyle, Charles y Gay Lussac tanques de gas: trabajar con esto es muy peligroso porque si llenas de más el tanque, el gas tiende a expandirse a cierto nivel de temperatura, por eso se aplica esta ley Un volumen gaseoso de un litro es calentado a presión constante desde 18 °C hasta 58 °C, ¿qué volumen final ocupará el gas?. Desarrollo Datos: V1 = 1 l P1 = P2 = P = constante t1 = 18 °C t2 = 58 °C Ecuación: P1.V1/T1 = P2.V2/T2 Si P = constante V1/T1 = V2/T2 Pasamos las temperaturas a temperaturas absolutas. t1 = 18 °C
- 3. T1 = 18 °C + 273,15 °C T1 = 291,15 K t2 = 58 °C T2 = 58 °C + 273,15 °C T2 = 331,15 K Despejamos V2: V2 = V1.T2/T1 V2 = 1 l.331,15 K/291,15 K V2 = 1,14 l DALTON La presión total de una mezcla es igual a la suma de las presiones parciales que ejercen los gases de forma independiente Ptot=Pp1+P p2 Normalmente en el buceo se utilizan mezclas gaseosas para respirar Una muestra de gas de hidrógeno se recoge sobre agua a 14.0º C. La presión de la mezcla resultante es de 113.0 kPa. ¿Cuál es la presión que se ejerce solamente por el hidrógeno seco? Formula necesaria: P(gas seco)= P(total) - P(vapor de agua) Es necesario saber la presión del vapor del agua a 14.0º C = 1.6 kPa Respuesta: P(gas seco) = 113.0 kPa - 1.6 kPa = 111.4 kPa ECUACION GENERAL DE GAS IDEAL Gas hipotético cuyo comportamiento de presión, volumen y pV=nRT ( la constante de los gases= R) Para hacer recipientes cilíndricos, para contener gases o líquidos con gas. ejemplo en latas de refresco, tanques de buceo ¿A qué temperatura se encuentran 20 moles de un gas, sometidos a una presión de 3 atm en un recipiente de 10 litros?
- 4. temperatura se puede describir completamente por medio de la ecuación general del gas ideal PV = nRT donde P = presión, V = volumen, n = moles T= temperatura R = constante igual a 0.08205 (litros atmosfera) / (mol °K) despejar T: T = PV/ nR T= 3 atm x 10 litros / 20 moles x 0.08205 (litros atmosfera) / (mol °K) T= 18.28 °K VICTOR HUMBERTO MARTINEZ FALCON GPO: 1 1594233