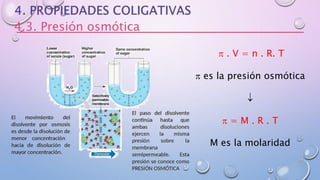
Este documento describe los diferentes estados de agregación de la materia (sólido, líquido y gaseoso), los cambios de fase, la ecuación de estado de los gases ideales, las disoluciones y sus propiedades. Explica que la materia puede encontrarse en tres estados dependiendo de la presión y temperatura, y que durante los cambios de fase la temperatura se mantiene constante. También resume la ecuación de estado de los gases ideales y la ley de Dalton sobre presiones parciales en mezclas de gases.