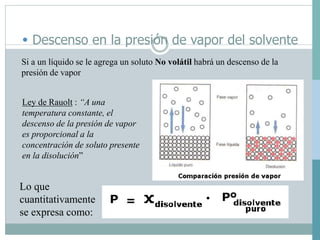
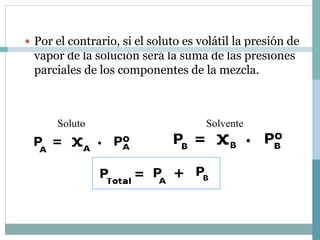
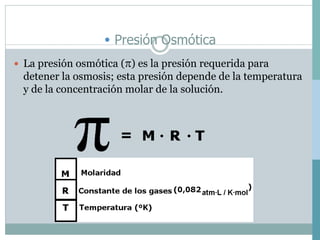
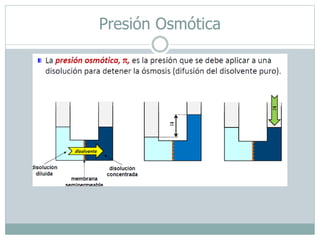
Las cuatro propiedades coligativas de las soluciones son: 1) Disminución de la presión de vapor, 2) Disminución del punto de congelación, 3) Aumento del punto de ebullición, 4) Presión osmótica. Estas propiedades dependen de la cantidad de soluto presente en la solución más que de la naturaleza del soluto.