El documento presenta una revisión histórica y teórica sobre ácidos y bases, desde las primeras descripciones de Robert Boyle hasta las teorías de Arrhenius y Brönsted-Lowry. Se discuten las propiedades de ácidos y bases, su comportamiento en disoluciones acuosas, y los conceptos de iones, disociación, y el cálculo del pH. Además, se exploran las reacciones de neutralización y la hidrólisis de sales, destacando su influencia en la acidez o basicidad de las disoluciones resultantes.









![4 Ácidos y bases
J
MLC-C
hena– IE
SAguilar yC
ano- E
stepa
Ionización del agua
Aunque muy pequeña, el agua presenta conductividad, lo que indica la
presencia de iones. Según la teoría de Brönsted y Lowry, estos proceden
de la autoionización del agua (autoprotólisis):
H 2 O + H 2 O
+ −
H3 O + OH
⟶
Ácido 1 Base 1
Base 2 Ácido 2
K= 3
[H O+
][OH−
]
2
[H 2 O]
La cantidad de agua ionizada es my pequeña con lo
que la concentración de agua la podemos considerar
constante.
2 + − −14
K [H 2 O] = Kw =[ H 3 O ][OH ] = 10
Producto iónico del agua
(a 25 ºC)](https://image.slidesharecdn.com/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-240607154218-d79eabe6/85/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-pptx-12-320.jpg)
![4 Ácidos y bases
J
MLC-C
hena– IE
SAguilar yC
ano- E
stepa
Ionización del agua
+ −
En agua pura por cada ion H3
O se forma uno OH . Estaríamos ante una disolución
neutra. Las concentraciones de ambos iones serían iguales.
+
Si se disuelve un ácido en agua pura, este aporta iones H3
O , con lo que debe
disminuir la concentración de OH−
para que se siga cumpliendo el producto iónico
del agua.
Si se disuelve una base, aumenta OH−
, y por tanto debe disminuir la concentración
+
de H3
O .
Disol. neutra
Disol. ácida
[H O+
] = [OH−
]
3
[H O+
] = 10-7
;[OH−
] = 10-7
3
[H O+
] > [OH−
] [H O+
] > 10-7
;[OH−
] < 10-7
3 3
[H O+
] < [OH−
] [H O+
] < 10-7
;[OH−
] > 10-7
3 3
Disol. básica](https://image.slidesharecdn.com/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-240607154218-d79eabe6/85/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-pptx-13-320.jpg)
![4 Ácidos y bases
J
MLC-C
hena– IE
SAguilar yC
ano- E
stepa
Disol. neutra
Disol. ácida
pH = pOH pH = 7 ; pOH = 7
pH < pOH pH < 7 ; pOH > 7
pH > pOH pH > 7 ; pOH < 7
Disol. básica
Concepto de pH
Debido al químico danés Sörensen en 1909:
pH = − log[H 3 O+
]
De la misma forma se define el pOH = log [OH−
]
El concepto se ha generalizado y también podemos definir:
pAg = log[Ag+
]; pK = log K, etc.](https://image.slidesharecdn.com/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-240607154218-d79eabe6/85/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-pptx-14-320.jpg)

![4 Ácidos y bases
J
MLC-C
hena– IE
SAguilar yC
ano- E
stepa
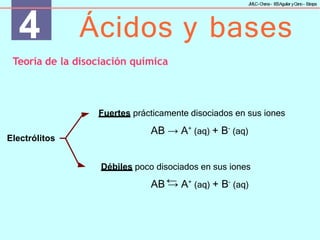
Fuerza relativa de ácidos y bases
Cuantitativamente, la fuerza de un ácido o una base se expresa mediante la
constante de equilibrio de disociación o ionización del ácido o base frente
al agua (referencia).
2
HA + H O 3
H O+
+ A−
K= 3
[H O+
][A−
]
[H2 O][HA]
K [H 2 O] = Ka = 3
[H O+
][A−
]
[HA]
2
B + H O HB+
+ OH−
[HB+
][OH−
]
K=
[H 2 O][B]
K [H 2 O] = Kb =
[HB+
][OH−
]
[B]
Ka es la constante de acidez y
mide la fuerza del ácido HA.
Kb es la constante de basicidad
y mide la fuerza de la base B.
⟶ ⟶](https://image.slidesharecdn.com/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-240607154218-d79eabe6/85/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-pptx-16-320.jpg)
![4 Ácidos y bases
J
MLC-C
hena– IE
SAguilar yC
ano- E
stepa
Relación entre las constantes de acidez y basicidad
La relación entre [H3O+
] y [OH−
] liga también las constantes de acidez y
basicidad de cualquier par ácidobase conjugado:
b
K =
[HA][OH−
]
[A−
]
Ka
= 3
[H O+
][A−
]
[HA]
2
HA + H O 3
H O+
+ A−
⟶
a
2
A−
+ H O ⟶ OH−
+ HA
K
Kb
ácido
Base conjugada
H 2 O + H2 O
+ −
H3 O +OH
⟶ Kw
w 3
+ −
K = [H O ][OH ]
Queda claro que Ka ∙ Kb = Kw , obvio ya que la ionización del agua es la
suma de las otras dos ecuaciones.](https://image.slidesharecdn.com/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-240607154218-d79eabe6/85/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-pptx-17-320.jpg)




![3 3
NH + + H O →NH + H O+
Cl− + H2O →no reacciona.
La disolución resultante tendrá una [ H3O+] mayor que la del agua
pura y será ácida.
4 Ácidos y bases
J
MLC-C
hena– IE
SAguilar yC
ano- E
stepa
Hidrólisis – Sal de ácido fuerte y base débil (NH4Cl)
La sal, por tratarse de un electrolito fuerte se encuentra totalmente
disociada en sus iones:
NH Cl(aq)⟶NH+
(aq)+ Cl−
(aq)
4 4
El catión NH4
+ es el ácido conjugado de una base débil (NH3), por
tanto su carácter ácido es mayor que el del agua y reacciona con ella,
sufre hidrólisis.
4 2 ←](https://image.slidesharecdn.com/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-240607154218-d79eabe6/85/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-pptx-22-320.jpg)
![Denominada constante de hidrólisis, que se corresponde con la Ka
(del ácido NH4 , conjugado de la base NH3).
+
Como Ka ∙ Kb = Kw , resulta que:
4 Ácidos y bases
J
MLC-C
hena– IE
SAguilar yC
ano- E
stepa
Hidrólisis – Sal de ácido fuerte y base débil (NH4Cl)
La constante de equilibrio del proceso de hidrólisis será:
h
K = 3 3
[NH ][H O+
]
4
[NH+
]
Kh≡Ka=
Kw
Kb](https://image.slidesharecdn.com/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-240607154218-d79eabe6/85/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-pptx-23-320.jpg)
![4 Ácidos y bases
J
MLC-C
hena– IE
SAguilar yC
ano- E
stepa
Hidrólisis – Sal de ácido débil y base fuerte (NaCH3COO)
La sal, por tratarse de un electrolito fuerte se encuentra totalmente
disociada en sus iones:
+ −
NaCH 3 COO(aq)⟶Na (aq)+ CH3 COO (aq)
El anión CH3COO− es la base conjugada de un ácido débil
(CH3COOH), por tanto su carácter básico es mayor que el del agua y
reacciona con ella, sufre hidrólisis.
CH3COO− + H2O →
←CH3COOH + OH−
Na+ + H2O →no reacciona.
La disolución resultante tendrá una [OH−] mayor que la del agua
pura y será básica.](https://image.slidesharecdn.com/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-240607154218-d79eabe6/85/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-pptx-24-320.jpg)
![4 Ácidos y bases
J
MLC-C
hena– IE
SAguilar yC
ano- E
stepa
Hidrólisis – Sal de ácido débil y base fuerte (NaCH3COO)
La constante de equilibrio del proceso de hidrólisis será:
h
K = 3
[CH COOH ][OH−
]
3
[CH COO−
]
Kh≡Kb=
Kw
Ka
(de la base CH3COO−,
Es decir, la constante de hidrólisis es la Kb
conjugada del ácido CH3COOH).
Como Ka ∙ Kb = Kw , resulta que:](https://image.slidesharecdn.com/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-240607154218-d79eabe6/85/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-pptx-25-320.jpg)



![4 Ácidos y bases
J
MLC-C
hena– IE
SAguilar yC
ano- E
stepa
Disoluciones reguladoras o amortiguadoras
Ácido débil + su base conjugada. Ej.: ácido acético + acetato de sodio.
+ −
NaCH 3 COO(aq)⟶Na (aq)+ CH3 COO (aq)
3 2 3 3
CH COOH (aq)+ H O(l)⟶
CH COO−
(aq)+ H O+
(aq)
a
K = 3 3
[CH COO−
][ H O+
]
[CH 3COOH ]
=
[CH COO−
] [H O+
]
3 sal 3
[CH3 COOH ]inicial
3
+
[H O ]= K a
[ácido]
[sal]](https://image.slidesharecdn.com/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-240607154218-d79eabe6/85/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-pptx-29-320.jpg)
![4 Ácidos y bases
J
MLC-C
hena– IE
SAguilar yC
ano- E
stepa
Disoluciones reguladoras o amortiguadoras
Base débil + su ácido conjugado. Ej.: amoniaco + cloruro de amonio.
NH Cl(aq)⟶NH+
(aq)+ Cl−
(aq)
4 4
3 2 4
NH (aq)+ H O (l)⟶NH+
(aq)+ OH−
(aq)
b
K = 4
[NH+
][OH−
]
3
[NH ]
= 4 sal
[NH+
] [OH−
]
[NH ]
3 inicial
−
[OH ]= Kb
[base]
[sal] 3
+
[H O ]=
Kw
b
[sal]
K [base]](https://image.slidesharecdn.com/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-240607154218-d79eabe6/85/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-pptx-30-320.jpg)

![4 Ácidos y bases
J
MLC-C
hena– IE
SAguilar yC
ano- E
stepa
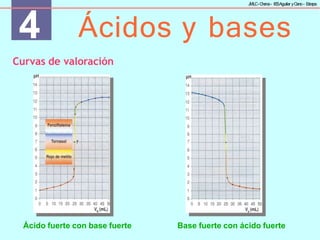
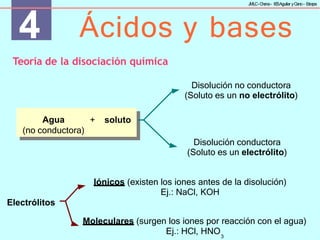
Valoraciones ácido-base
Se usan para determinar la concentración de un ácido o una base.
Se halla la cantidad de base (o ácido) de concentración conocida,
añadiéndola gradualmente mediante una bureta, que hace falta
para neutralizar una cierta cantidad de ácido (o base) de
concentración desconocida. El punto final de la valoración o punto
de equivalencia se alcanza cuando [H3O+] es igual a [OH−], que se
conoce por el cambio de color del indicador utilizado.](https://image.slidesharecdn.com/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-240607154218-d79eabe6/85/eb80faa2-2ab6-4e0b-89aa-9512ac3ca38d-pptx-32-320.jpg)