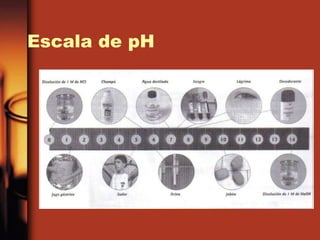
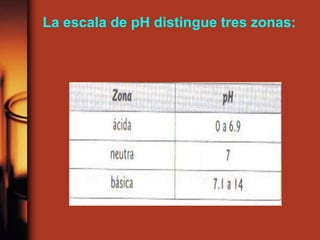
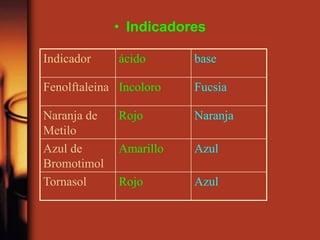
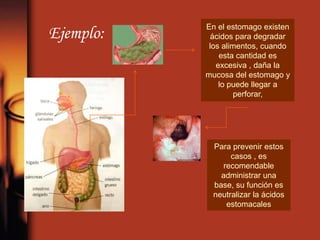
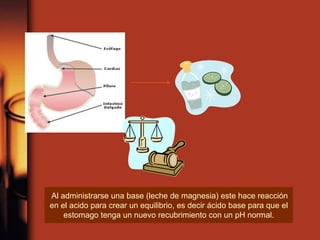
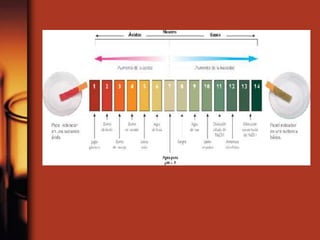
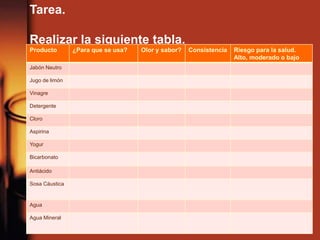
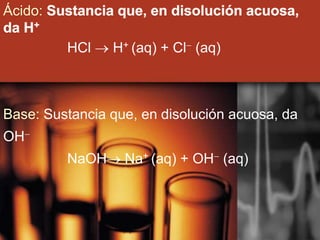
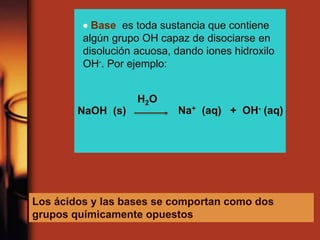
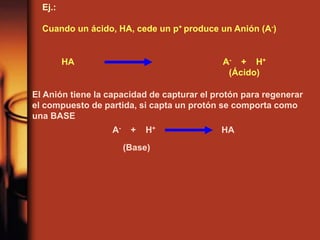
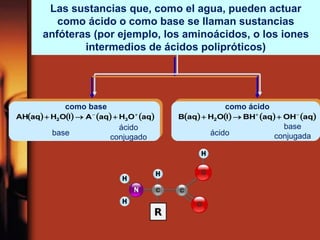
El documento describe la evolución de las teorías sobre ácidos y bases. Inicialmente se definían por sus propiedades como el sabor, pero Boyle estableció su caracterización basada en propiedades. Más tarde, Arrhenius propuso que los ácidos producen iones H+ e hidrógeno en solución acuosa, mientras que las bases producen iones OH-. Finalmente, Brønsted y Lowry expandieron esta teoría para incluir cualquier sustancia que ceda o acepte protones, no limitándose al agua.























![28
[A–] [H+][HA]
Ácido fuerte
[H+][A–]
[HA][HA]
Ácido débil](https://image.slidesharecdn.com/acidosybases-180227061521/85/Acidos-y-bases-28-320.jpg)