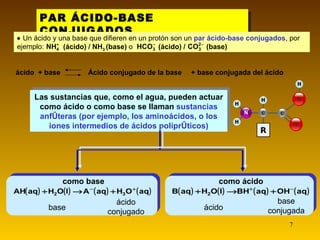
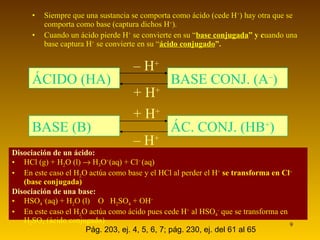
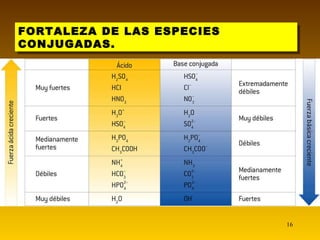
El documento resume las teorías de Arrhenius y Brönsted-Lowry sobre ácidos y bases. Según Arrhenius, los ácidos donan iones H+ y las bases donan iones OH- en agua. Brönsted-Lowry amplía esto al definir ácidos como aceptores de protones y bases como donantes. También introduce la noción de pares ácido-base conjugados que difieren en un solo protón. La autoionización del agua produce equilibrio entre iones H3O+ y OH-. La fuerza de los ácidos y bases depen







![AUTOIONIZACIÓN DEL AGUA. Una disolución es: Ácida Neutra Básica si [H 3 O + ] > [OH - ] si [H 3 O + ] = [OH - ] si [H 3 O + ] < [OH - ] En una disolución acuosa diluida, la [H 2 O] es muy grande y permanece prácticamente constante (55,5 M), por lo que se incluye en el valor de la constante de equilibrio, obteniéndose una nueva, K w , que recibe el nombre de producto iónico del agua: K w = K c [ H 2 O] 2 = [H 3 O + ][OH - ] En cualquier disolución acuosa, las variables [H 3 O + ] y [OH - ] son inversamente proporcionales Reacción muy desplazada hacia la izquierda la constante de equilibrio es muy pequeña El agua se autoioniza según la ecuación H 2 O + H 2 O H 3 O + (aq) + OH - (aq) K c = [H 3 O + ][OH - ] [H 2 O] 2 = 3,2 10 -18 (a 25ºC)](https://image.slidesharecdn.com/acidobasecompleto-110502043034-phpapp01/85/Acido-base-tema-2-bachiller-quimica-10-320.jpg)


![[A – ] [H + ] [HA] Ácido fuerte [ H + ] [A – ] [HA] [HA] Ácido débil](https://image.slidesharecdn.com/acidobasecompleto-110502043034-phpapp01/85/Acido-base-tema-2-bachiller-quimica-13-320.jpg)



![Ácidos débiles. Constante de ionización (Pág. 208) Cuanto más fuerte es el ácido, mayor será K a , y mayor tendencia tiene a formarse A - El valor de la constante, K a , es una medida de la fuerza de un ácido Como todas las constantes de equilibrio, K a depende de la temperatura La constante de equilibrio K a se denomina constante de acidez o de ionización del ácido , e incluye el producto Kc * [H 2 O] . Para un ácido cualquiera tiene la expresión: La constante del equilibrio anterior, K c , se expresará como: Se denominan ácidos débiles a los ácidos que se disocian sólo parcialmente en agua: AH (aq) + H 2 O (l) A - (aq) + H 3 O + (aq) K c = [A - ][H 3 O + ] [AH] [H 2 O] eq K a = [A - ][H 3 O + ] [AH] eq](https://image.slidesharecdn.com/acidobasecompleto-110502043034-phpapp01/85/Acido-base-tema-2-bachiller-quimica-18-320.jpg)

![Bases débiles. Constante de ionización (Pág. 209) Se denominan bases débiles, a las bases que se disocian sólo parcialmente en agua, tras aceptar un protón de ésta: B (aq) + H 2 O (l) BH + (aq) + OH - (aq) Cuanto más fuerte es la base, mayor es K b y el equilibrio se desplaza más a la derecha. El valor de la constante, K b , es una medida de la fuerza de una base. Como todas las constantes de equilibrio, K b depende de la temperatura. La constante de equilibrio K b se denomina constante de basicidad o de ionización de la base, e incluye el producto Kc * [H 2 O] . Para una base cualquiera tiene la expresión: La constante del equilibrio anterior, K c , se expresará como: K c = [OH - ][BH + ] [B] [H 2 O] eq K b = [OH - ][BH + ] [B] eq](https://image.slidesharecdn.com/acidobasecompleto-110502043034-phpapp01/85/Acido-base-tema-2-bachiller-quimica-20-320.jpg)

![Relación entre Ka, Kb y Kw (pág. 209) Conocida la K b para una base se puede calcular la K a de su ácido conjugado Pág. 213, ej. 15, 16; pág. 230, ej. 67 Multiplicando ambas expresiones y simplificando: [AH][OH - ] [A - ] K a K b = [A - ] [H 3 O + ] [AH] = [H 3 O + ][OH - ] = K w Por tanto conocido, el valor de Kb para un base, se puede calcular el valor de Ka de su ácido conjugado: K w = K a K b (y viceversa) K a = [A - ][H 3 O + ] [AH] AH + H 2 O A - + H 3 O + K b = [AH][OH - ] [A - ] A - + H 2 O (l) AH + OH -](https://image.slidesharecdn.com/acidobasecompleto-110502043034-phpapp01/85/Acido-base-tema-2-bachiller-quimica-22-320.jpg)


![Grado de ionización ( α ) en Ka y Kb (p. 212) Pág. 213, ej. 18, 19, 20 El grado de ionización α de un ácido o una base débiles es la relación entre la concentración de iones en el equilibrio (x) y la concentración inicial (M). Expresa el tanto por ciento de moléculas ionizadas. [AH] [H 3 0 + ] [A - ] Molaridad inicial ácido débil M 0 0 Cambios para el equilibrio -Mα + Mα + Mα Molaridad en el equilibrio M- Mα Mα Mα x —— M M α 2 ——— 1- α](https://image.slidesharecdn.com/acidobasecompleto-110502043034-phpapp01/85/Acido-base-tema-2-bachiller-quimica-25-320.jpg)

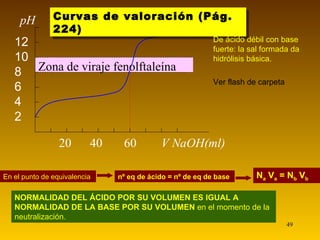
![CONCEPTO DE pH (pág. 214) Para una temperatura dada, el producto iónico del agua permanece constante El valor del pH permite asignar el carácter ácido o básico de las disoluciones Por tanto, para el agua pura: pH = - log 10 -7 = - (-7) = 7 A 25ºC, K w = [H 3 O + ][OH - ] = 10 -14 moles 2 L -2 y en el agua pura, [H 3 O + ] = [OH - ] = 10 -7 mol L -1 El pH de una disolución es el logaritmo en base 10, con el signo cambiado, de la concentración de iones H 3 O + expresada en mol L -1 . Por tanto, [H 3 O + ] = 10 -pH (mol L -1 ) [H 3 O + ] > [OH - ] Disolución ácida [H 3 O + ] > 10 -7 mol L -1 pH < 7 [H 3 O + ] = [OH - ] Disolución neutra [H 3 O + ]= 10 -7 mol L -1 pH = 7 [H 3 O + ] < [OH - ] Disolución básica [H 3 O + ] < 10 -7 mol L -1 pH > 7](https://image.slidesharecdn.com/acidobasecompleto-110502043034-phpapp01/85/Acido-base-tema-2-bachiller-quimica-27-320.jpg)






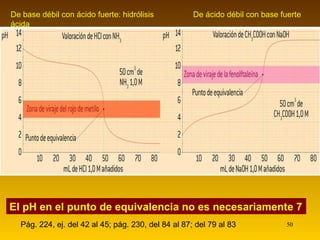
![Comportamiento del sistema ácido acético / acetato de sodio (pág. 216) Las reacciones químicas que tenemos en este sistema son: CH 3 –COOH (aq) + H 2 O(l) CH 3 –COO – (aq)+ H 3 O + (aq) Si añadimos una pequeña cantidad de ácido a ese sistema, el equilibrio se desplazará hacia la izquierda, manteniéndose el pH en valores parecidos a los iniciales. Si añadimos una pequeña cantidad de base, reaccionará con los hidronios presentes, desplazando de nuevo el equilibrio hacia la izquierda, manteniendo pues el pH aproximadamente constante . La capacidad amortiguadora de un sistema depende: * Del número de moles de ácido y base (deben ser altos para que la capacidad también lo sea) * Del cociente [base]/[ácido]. (para que la capacidad sea alta, ha de ser próximo a 1. Si es < 0.1 ó > 10, no será muy eficiente. Mayor eficiencia: cuando pH = pK a ) CH 3 COONa (aq) H 2 O CH 3 COO - (aq) + Na + (aq)](https://image.slidesharecdn.com/acidobasecompleto-110502043034-phpapp01/85/Acido-base-tema-2-bachiller-quimica-34-320.jpg)




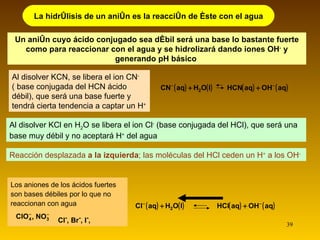









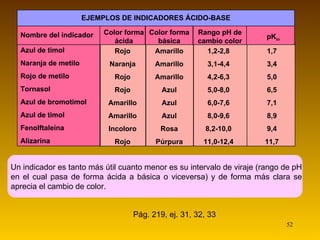
![Indicadores ácido- base (pág. 218) Son ácidos o bases débiles cuyo color es diferente a su base o ácido conjugado El cambio de color se considera apreciable cuando [HIn] > 10·[In – ] o bien cuando [HIn]< 1/10·[In – ] ; si se parecen las concentraciones, mezcla de colores Si se añade una pequeña cantidad de indicador a un ácido AH: HA + H 2 O A – + H 3 O + HIn (aq) + H 2 O (l) In - (aq) + H 3 O + (aq) Al aumentar la concentración de hidronio, por el efecto del ion común, el equilibrio del indicador se desplazará hacia la izquierda, predominando entonces su color ácido. Al combinar el indicador con una base, los hidroxilos que proceden de ésta consumirán los hidronios del equilibrio del indicador, que se desplazará entonces hacia la derecha, predominado su color básico. HIn (aq) + H 2 O (l) Forma ácida (color 1) In - (aq) + H 3 O + (aq) Forma básica (color 2) La constante de acidez del indicador es: K In = [In - ] [H 3 O + ] [HIn] [HIn] [In - ] [H 3 O + ] K In =](https://image.slidesharecdn.com/acidobasecompleto-110502043034-phpapp01/85/Acido-base-tema-2-bachiller-quimica-51-320.jpg)