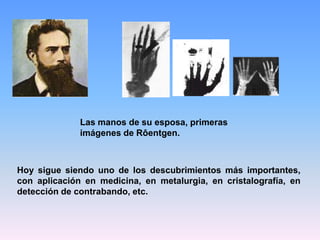
El documento describe la evolución histórica de los modelos atómicos desde la antigüedad hasta el modelo actual. Los primeros modelos propuestos por Demócrito y Dalton veían al átomo como una esfera indivisible. Posteriormente, los descubrimientos de la radiactividad y el electrón llevaron a Thomson a proponer un modelo de átomo con electrones inmersos en una esfera positiva. El experimento de Rutherford reveló la existencia de un núcleo atómico pequeño y denso, dando origen al modelo atómico