1) Los primeros modelos atómicos fueron propuestos por filósofos griegos como Demócrito, quien sugirió que la materia estaba compuesta de átomos indivisibles.
2) En el siglo XIX, Dalton formuló la teoría atómica moderna basada en los átomos como partículas indivisibles.
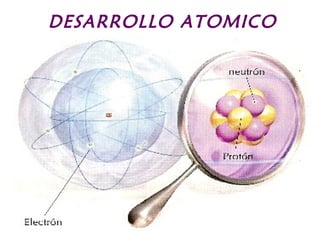
3) Experimentos en el siglo XX revelaron la estructura interna del átomo, incluyendo el descubrimiento del electrón, núcleo y neutrones.