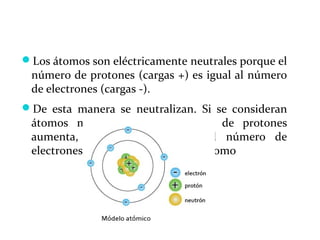
El documento resume la historia de la teoría atómica desde Dalton hasta Chadwick, incluyendo los modelos de Thomson, Rutherford y Chadwick. Dalton propuso que la materia está compuesta de átomos indivisibles. Thomson propuso un modelo en el que los electrones estaban dispersos en una esfera positiva. Rutherford determinó que la mayor parte de la masa y la carga de un átomo están concentradas en un núcleo central pequeño. Finalmente, Chadwick descubrió el neutrón y estableció que los neutrones residen en el núcleo j