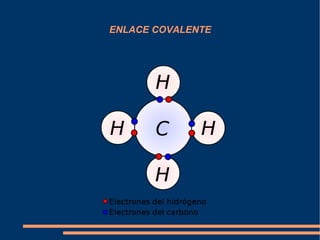
Enlace covalente
- 2. Modelo de Lewis El enlace covalente consiste en la union de dos atomos que comparten uno o mas pares de electrones. Enlace simple: Enlace doble: Enlace triple:
- 3. Enlace coordinado: La covalencia de un elemento es su capacidad para formar enlaces covalentes. Ejemplo: el oxigeno muestra la covalencia 2 en el agua, porque forma dos enlaces covalentes.
- 4. Estructuras de Lewis de las moleculas poliatomicas Resonancia: la estructura es intermedia entre las dos posibles. Los enlaces C-C no son dobles ni simples, sino que representan una longitud intermedia.
- 5. Teoria de enlace de valencia El modelo de Lewis dejaba algunas cuestiones sin resolver. El modelo mecano-cuantico da respuestas a esas y otras preguntas. Una de las teorias dentro de ese modelo es la teoria de enlace de valencia.
- 6. Enlace covalente: - Superposicion de dos orbitales semiocupados de atomos diferentes con emparejamiento de los electrones de espin antiparalelo. - Covalencia: numero de enlaces covalentes que puede formar un elemento. - Covalencia multiple: se pueden desemparejar un numero variable de electrones. Esto se debe a la promocion electronica.
- 7. Parametros de enlace Energia de enlace: - La energia o entalpia de enlace es la variacion de entalpia que tiene lugar cuando se disocia un mol de moleculas en estado gaseoso. - Con la entalpia de enlace se la fuerza de un enlace. - Todas las entalpias de enlace son positivas. Longitud de enlace: - Es la distancia entre los nucleos de los dos atomos unidos mediante un enlace covalente. - Depende del tamaño de los atomos enlazados.
- 8. - Longitud enlace triple < enlace doble < enlace simple - según la forma de solaparse: enlace σ o enlace π
- 9. Angulo de enlace: - Es el angulo que forman las rectas que pasan por los nucleos atomicos o direcciones de enlace. - Puede predecirse mediante el metodo RPENV
- 10. Polaridad del enlace: - El enlace apolar: enlace covalente en el que los electrones son compartidos por igual por los dos atomos, de modo que la densidad electronica es simetrica respecto de los dos nucleos. - El enlace polar: uno de los dos atomos por ser mas electronegativo que el otro desplaza hacia el la carga electronica compartida.
- 11. Hibridacion de orbitales atomicos El metodo de hibridacion de orbitales justifica la forma geometrica de muchas moleculas. Hibridacion sp3:
- 12. Hibridacion sp2: Hibridacion sp: