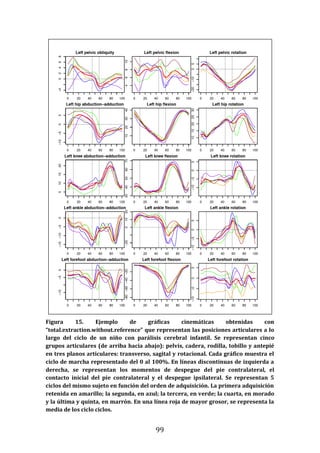
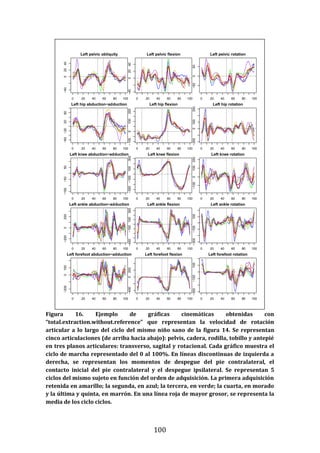
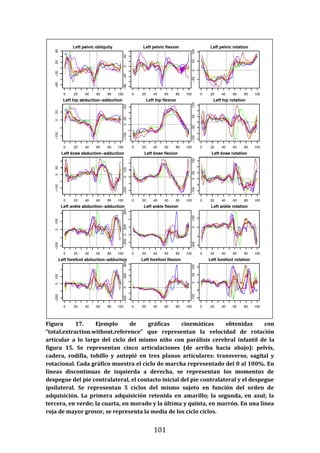
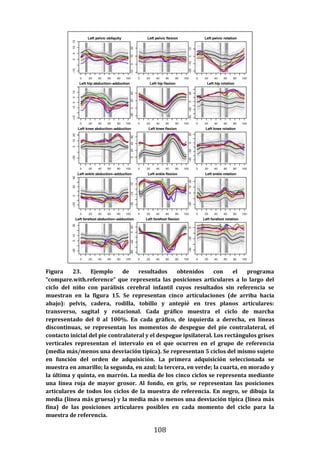
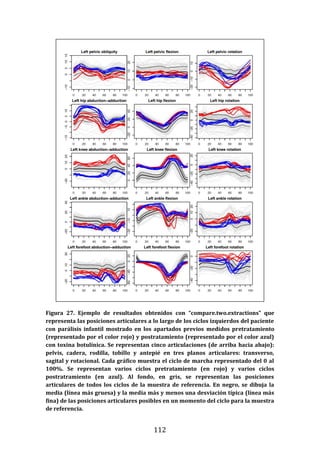
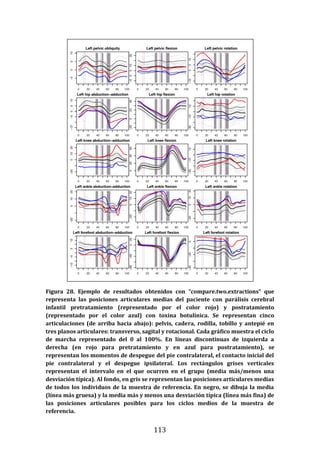
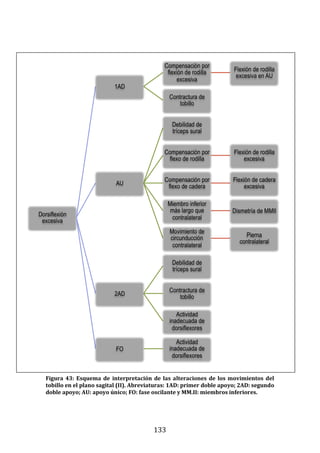
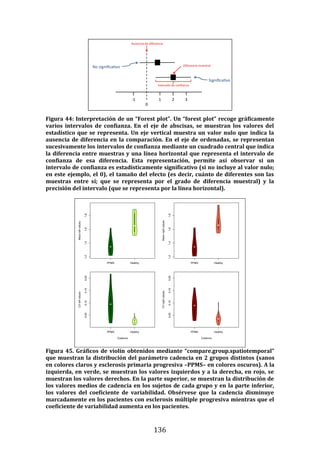
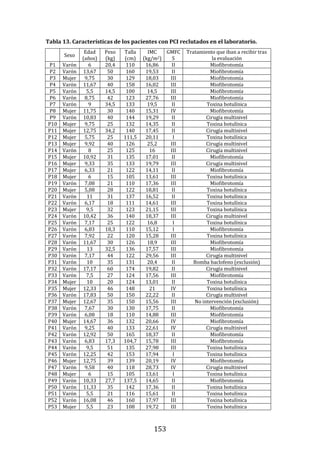
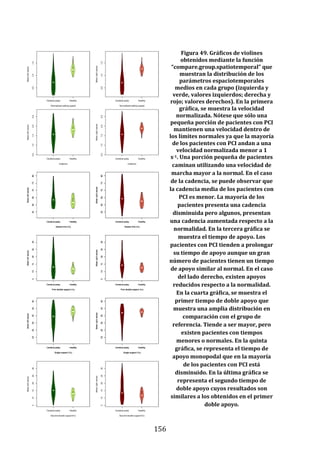
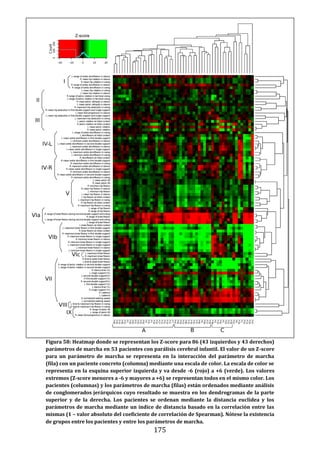
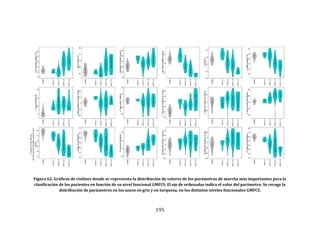
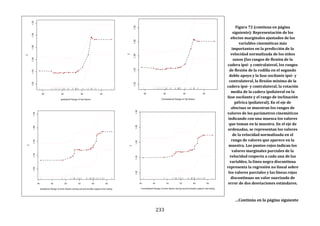
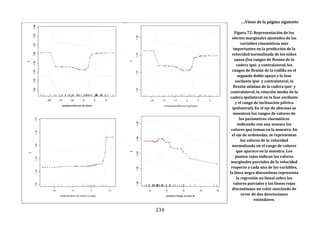
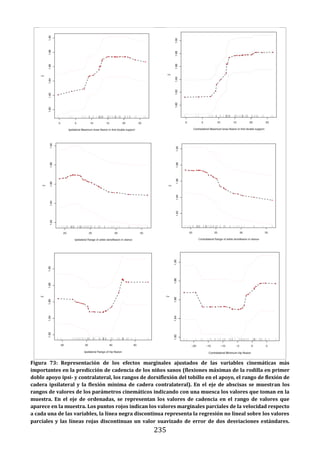
Este documento presenta una tesis doctoral sobre el análisis instrumental de la marcha en niños con parálisis cerebral infantil. La tesis propone cuatro objetivos: 1) Desarrollar una herramienta de software para automatizar el análisis de datos de marcha. 2) Aplicar esta herramienta para analizar la marcha en niños sanos y con parálisis cerebral, validando resultados previos y detectando nuevos patrones. 3) Estudiar la relación entre parámetros de marcha y funcionalidad motora. 4) Analizar la relación entre par



























































































![106
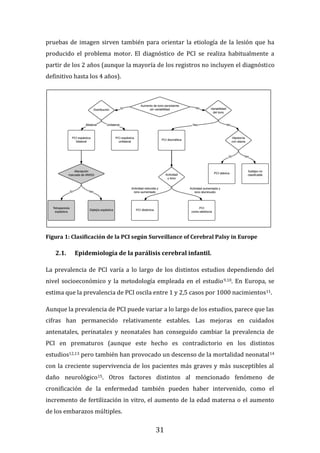
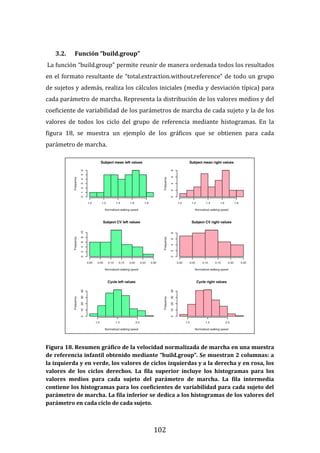
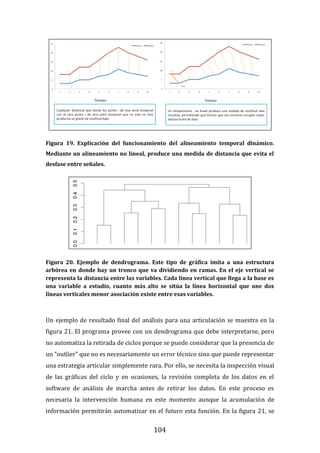
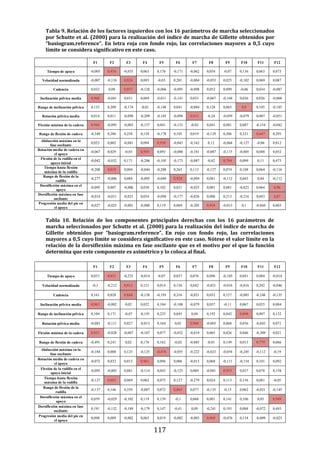
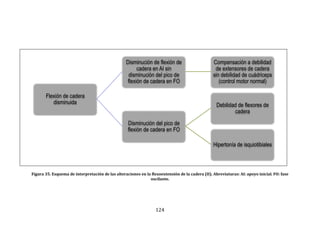
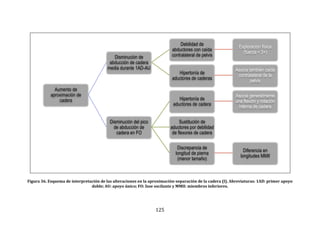
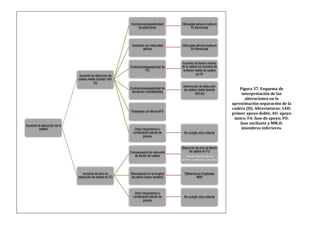
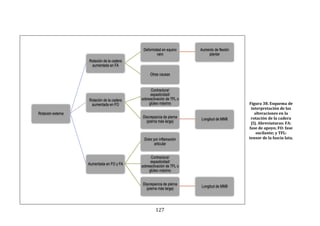
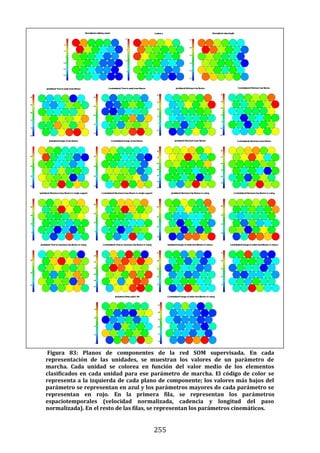
Figura 22. Dendrograma obtenido con build.group al que se le han retirado los
ciclos “outliers” mostrados en la figura previa. Se representan los resultados de la
base de datos definitiva.
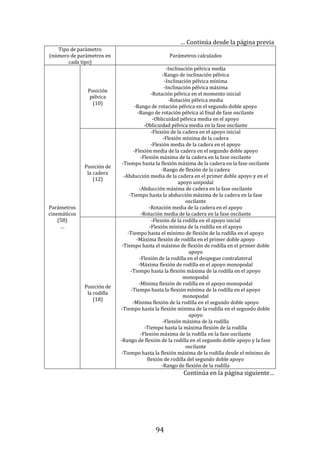
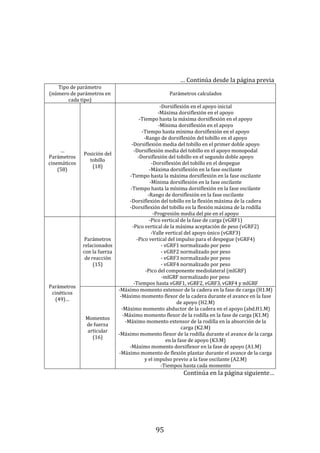
La función “build.group” utiliza como argumentos a los resultados de cada sujeto
en formato “total.extraction.without.reference”, al número máximo de ciclos
recogidos por sujeto, un controlador para definir si se desea guardar o no los
códigos de sujeto utilizados en “total.extraction.without.reference” y controladores
para definir el tipo de extracción de datos cinéticos deseados. Como resultados, la
función “build.group” produce una lista que incluye a un vector con los códigos
usados para cada sujeto, un vector con los códigos usados para cada ciclo, una
matriz que resume la estadística de los parámetros de marcha en el grupo, una
matriz que recoge los datos antropométricos, una lista con todos los objetos
“total.extraction.without.reference” incluidos, listas que incluyen los valores
medios y el coeficiente de variabilidad por sujeto y los valores de cada ciclo del
sujeto de cada parámetro espaciotemporal, cinemático, cinético o de distancia
calculado, una lista con la matriz de distancia DTW, listas con las posiciones,
velocidades y aceleraciones angulares de cada ciclo, listas con las posiciones,
velocidades y aceleraciones angulares medias del grupo, una matriz con datos
adicionales para permitir representaciones gráficas posteriores y un vector con la
fecha de recogida de los datos con la función.
227
375
451
455
347
381
383
226
90
88
377
406
374
449
148
68
146
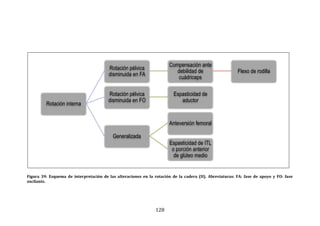
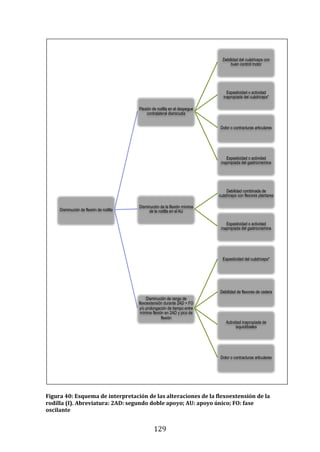
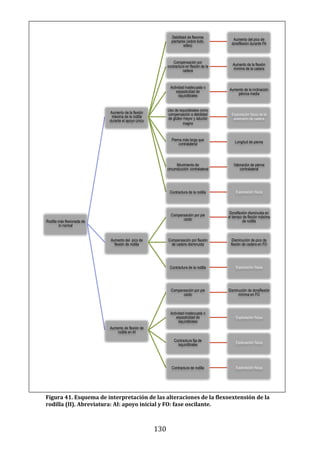
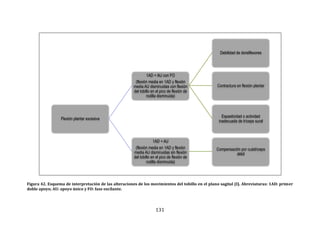
149
448
447
450
32
82
5
81
409
27
179
95
251
252
176
257
372
371
373
253
30
175
291
256
289
64
258
80
231
304
26
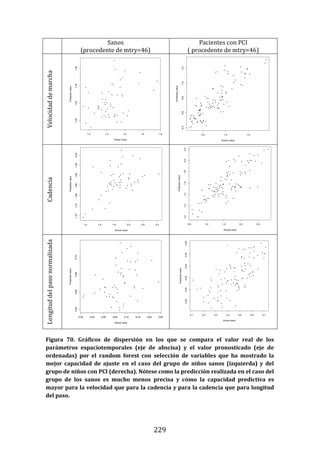
78
370
169
9
7
8
376
6
233
283
338
156
116
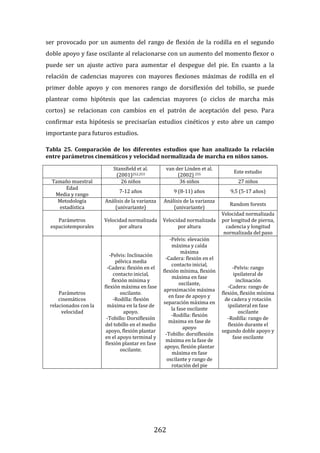
102
282
100
34
35
290
36
335
397
167
399
171
337
37
336
79
229
89
103
232
54
3
55
359
358
360
25
28
31
144
145
4
288
147
410
192
407
13
190
177
254
178
240
239
241
97
98
217
14
242
67
15
216
66
255
395
29
63
259
92
166
191
164
165
96
94
65
93
16
215
218
408
1
2
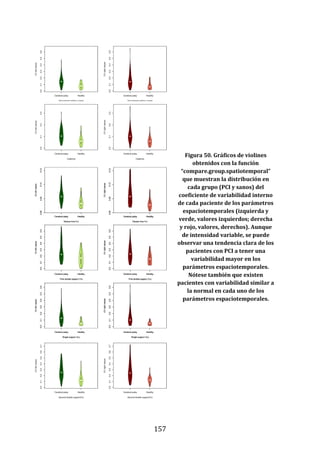
393
394
19
195
72
433
139
140
194
137
138
83
278
295
48
277
302
69
301
244
300
298
299
306
435
243
203
436
201
204
202
310
265
268
70
120
307
86
308
85
51
276
84
87
71
279
266
269
52
267
49
50
238
193
172
173
188
185
187
205
405
401
403
11
122
186
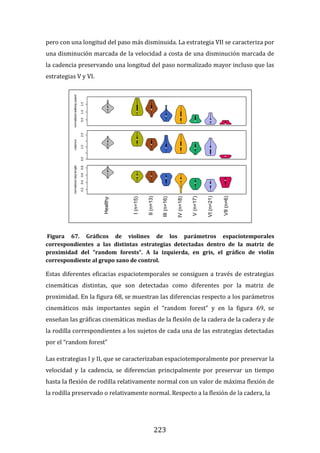
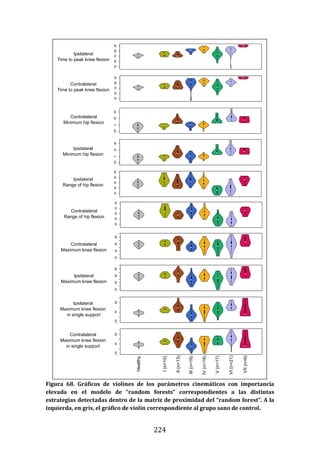
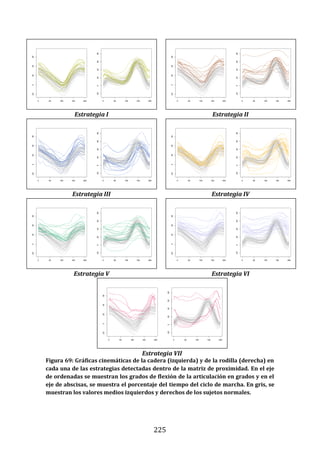
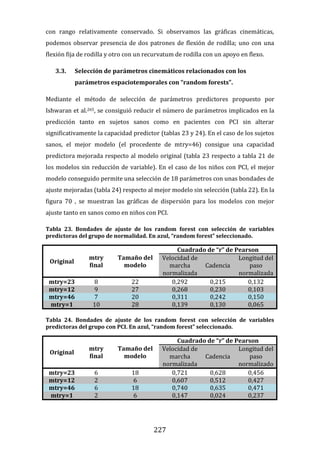
189
325
326
77
404
343
197
344
18
245
133
236
441
129
235
124
440
437
105
106
150
246
402
212
296
430
431
348
351
312
311
438
207
439
237
119
127
247
47
206
12
107
428
104
45
46
327
329
309
328
121
123
43
44
41
10
429
108
275
40
42
434
73
38
39
293
297
199
432
196
198
330
294
200
331
345
320
321
386
117
125
118
128
60
62
318
58
61
224
317
170
319
114
287
153
168
225
303
357
400
364
59
248
389
415
365
354
413
414
390
391
292
361
158
316
230
157
378
340
315
384
385
387
380
392
356
182
454
213
261
263
214
262
181
209
366
341
349
208
222
221
270
274
271
273
313
211
272
22
131
353
130
132
342
368
21
369
388
219
352
355
183
379
382
264
223
412
180
24
23
184
110
249
109
111
250
445
446
443
444
135
442
152
174
74
134
136
151
411
367
322
323
324
220
210
126
350
142
339
280
281
284
363
228
362
396
398
421
101
53
99
33
56
57
141
305
112
285
113
115
419
286
416
417
418
260
420
423
424
346
422
155
332
91
314
333
334
143
234
426
425
427
17
20
76
452
161
159
160
163
162
75
154
453
0
500
1000
1500
2000
2500
3000
Cluster Dendrogram
hclust (*, "average")
as.dist(cp.labA[[12]][[10]])
Height](https://image.slidesharecdn.com/gomezandresdavid-220401222051/85/gomez_andres_david-pdf-105-320.jpg)


































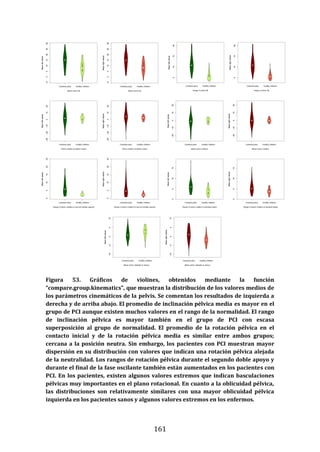
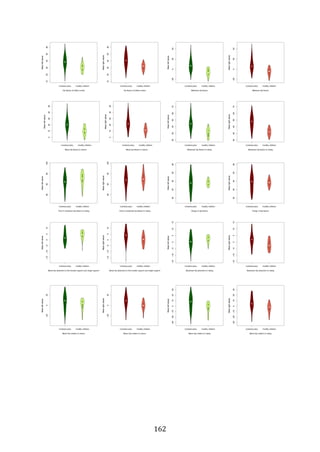

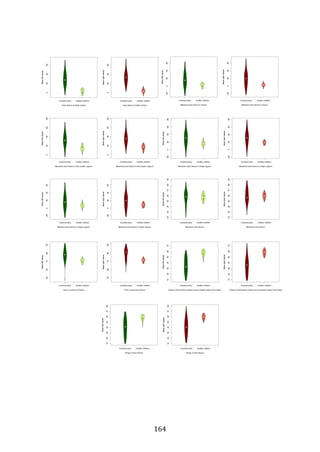























































































![281
function classification system (CFCS). Research in developmental disabilities
2014;35:2651-7.
72. Novak I, McIntyre S, Morgan C, et al. A systematic review of interventions
for children with cerebral palsy: state of the evidence. Developmental medicine
and child neurology 2013;55:885-910.
73. Gomez-Andres D, Pulido-Valdeolivas I, Martin-Gonzalo JA, et al. [External
evaluation of gait and functional changes after a single-session multiple
myofibrotenotomy in school-aged children with spastic diplegia]. Revista de
neurologia 2014;58:247-54.
74. McGinley JL, Dobson F, Ganeshalingam R, Shore BJ, Rutz E, Graham HK.
Single-event multilevel surgery for children with cerebral palsy: a systematic
review. Developmental medicine and child neurology 2012;54:117-28.
75. Lamberts RP, Burger M, du Toit J, Langerak NG. A Systematic Review of the
Effects of Single-Event Multilevel Surgery on Gait Parameters in Children with
Spastic Cerebral Palsy. PloS one 2016;11:e0164686.
76. Moore GF, Audrey S, Barker M, et al. Process evaluation of complex
interventions: Medical Research Council guidance. Bmj 2015;350:h1258.
77. Fletcher A, Jamal F, Moore G, Evans RE, Murphy S, Bonell C. Realist complex
intervention science: Applying realist principles across all phases of the Medical
Research Council framework for developing and evaluating complex interventions.
Evaluation 2016;22:286-303.
78. Gage JR. The treatment of gait problems in cerebral palsy. London: Mac
Keith Press; 2004.
79. Whittle M, Levine DPDPT, Richards J, Whittle MGa. Whittle's gait analysis.
5th ed. / edited by David Levine, Jim Richards, Michael W. Whittle. ed. Edinburgh:
Churchill Livingston; 2012.
80. Sheridan PL, Hausdorff JM. The role of higher-level cognitive function in
gait: executive dysfunction contributes to fall risk in Alzheimer's disease. Dementia
and geriatric cognitive disorders 2007;24:125-37.
81. Perry J, Burnfield JM. Gait analysis : normal and pathological function. 2nd
ed. ed. Thorofare, N.J.: SLACK; 2010.
82. Rose J, Gamble JG. Human walking. 3rd ed. ed. Philadelphia, Pa. ; London:
Lippincott Williams & Wilkins; 2006.
83. Shumway-Cook A, Woollacott MH. Motor control : translating research into
clinical practice. 4th ed. Philadelphia: Wolters Kluwer Health/Lippincott Williams
& Wilkins; 2012.
84. Goldfield EC. Emergent forms : origins and early development of human
action and perception: Oxford University Press; 1995.
85. Brown TG. On the nature of the fundamental activity of the nervous centres;
together with an analysis of the conditioning of rhythmic activity in progression,
and a theory of the evolution of function in the nervous system. The Journal of
physiology 1914;48:18-46.
86. Whelan PJ, Hiebert GW, Pearson KG. Stimulation of the group I extensor
afferents prolongs the stance phase in walking cats. Experimental brain research
1995;103:20-30.
87. Latash ML, Scholz JP, Schoner G. Toward a new theory of motor synergies.
Motor control 2007;11:276-308.
88. Thelen E, Smith LB. A dynamic systems approach to the development of
cognition and action: Cambridge.](https://image.slidesharecdn.com/gomezandresdavid-220401222051/85/gomez_andres_david-pdf-280-320.jpg)










