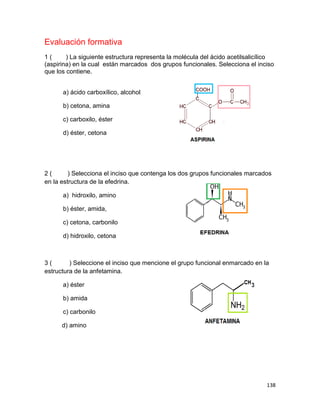
(F)
(F)
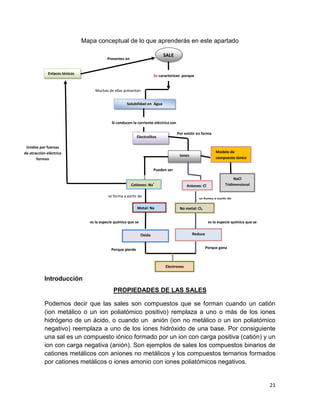
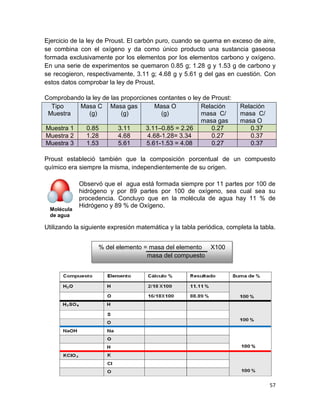
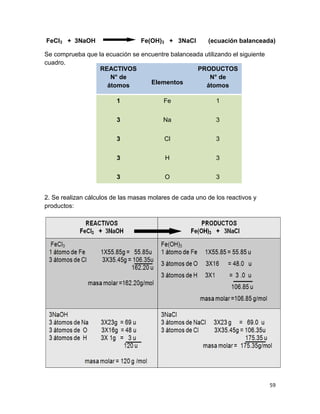
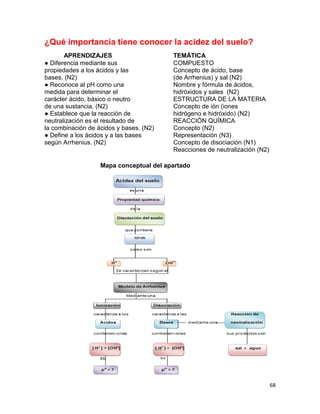
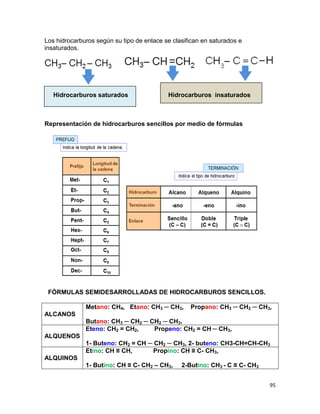
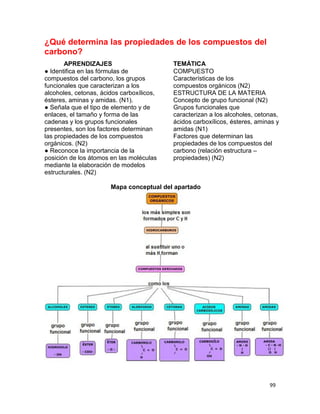
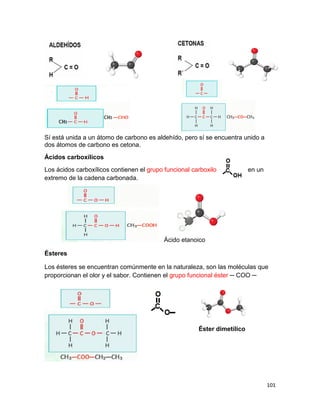
(V)
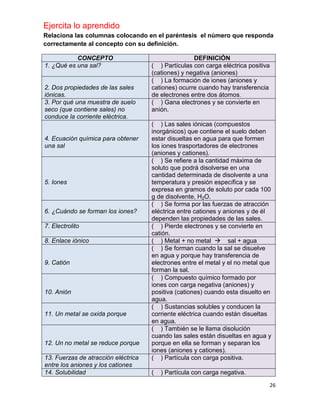
(V)
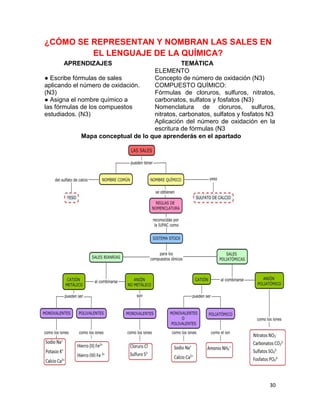
(V)
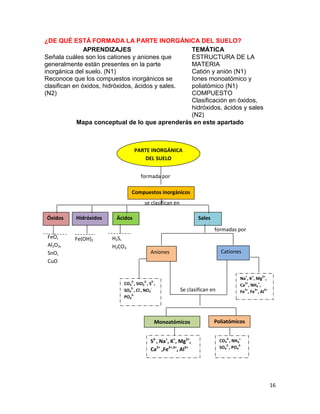
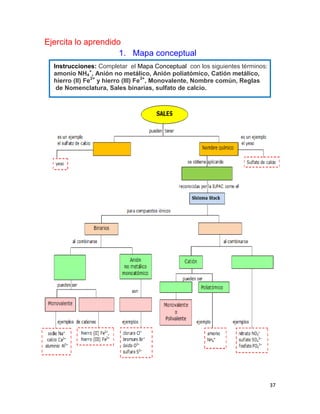
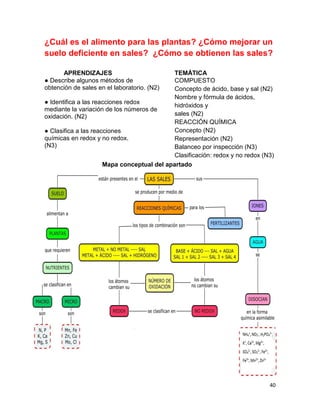
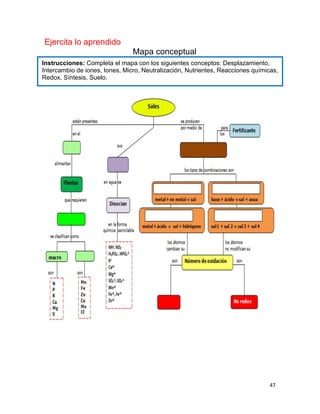
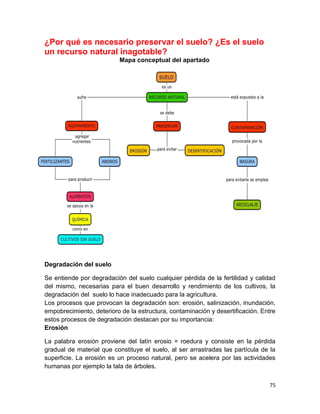
1. Elabora un esquema que muestre las principales funciones del suelo.
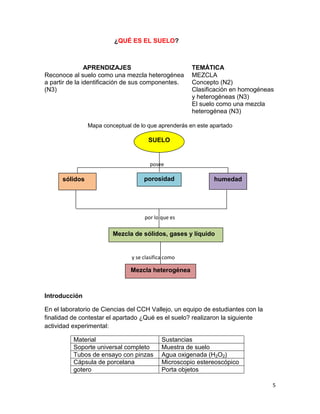
SUELO
Hábitat de organismos
Amortiguador del clima
Productor de alimentos
Productor de fibras para vestido y maderas
Soporte y proveedor de nutrimentos para las plantas














































































































![140
Bibliografía
Becerra-Moreno, A., (1998). Conservación de suelos y desarrollo
sustentable, ¿utopía o posibilidad en México? Artículo., Terra, Volumen 16,
Numero 2, México, México.
Chamizo, A. y Garritz, A., (1991). Química terrestre., Colección la ciencia
desde México, Núm. 97, F. C. E., México, México
Timberlake, K. C. (1997).Química. Introducción a la Química General, a la
Orgánica y a la Bioquímica., Oxford University Press-Harla, México, México
Vega, L y Rico, A., (2012). Banco de Reactivos para la asignatura de
Química II., Seminario de Química del Plantel Naucalpan Vespertino
(SEQUIN). Colegio De Ciencias Y Humanidades Plantel Naucalpan.,
UNAM, México, México.
Sanjurjo, M., (1996) La aspirina, legado de la medicina tradicional.
Revista Educación Química. México, Facultad de Química, UNAM,
volumen 7, núm. 1, Pag. 13 - 15.
Referencias electrónicas
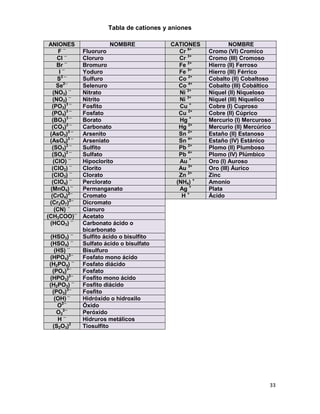
Clasificación de los componentes solidos del suelo. Video, (2012)
[Consultada el 26 de octubre de 2013. Disponible en
https://www.youtube.com/watch?v=x3wTbU01Tkg ]
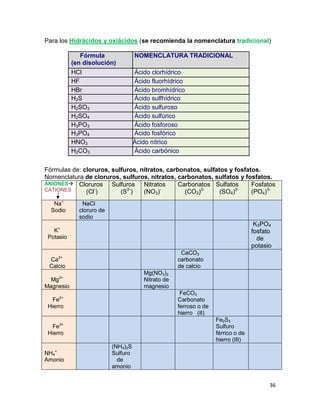
Enlace químico y regla del octeto. Video (2009) [Consultada el 4 de
noviembre de 2009. Disponible
en https://www.youtube.com/watch?feature=player_embedded&v=uvZCFu
pdI4U#t=17 ]
http://objetos.unam.mx/quimica/suelo/index.html]
Oxidación y reducción Flash (2010) [Consultada el 29 de septiembre de
2013. Disponible en
http://www.virtual.unal.edu.co/cursos/sedes/medellin/nivelacion/uv00007/lec
ciones/unidad8/reacciones_pagina5b.swf ]
http://campus.fi.uba.ar/pluginfile.php/58222/mod_resource/content/0/Materia
l_Adicional/Nomenclatura_CBC.pdf ]
INITE. Grupos funcionales. (2010). Flash. [Consultada el 15 de mayo de
2014. Disponible en
http://gc.initelabs.com/recursos/files/r147r/w4872w/u9eg_f3b.swf]
Modelos Moleculares. (2012). Flash. [Consultada el 28 de mayo de 2014.
Disponible en http://biomodel.uah.es/model3j/monosac.htm ]
La aspirina. Bayer. (2011). [Consultada el 5 de febrero de 2014. Disponible
en http://www.cardioaspirina-
ca.com/scripts/pages/es/historia/la_historia_de_aspirina/ ]
La Yerba Mate
http://www.juntadeandalucia.es/averroes/~cepco3/escuelatic2.0/MATERIAL/
FLASH/Conocimiento%20del%20Medio/La%20Yerba%20Mate.swf](https://image.slidesharecdn.com/guaqii20152016-160423225015/85/Guia-de-Quimica-II-2015-2016-148-320.jpg)
