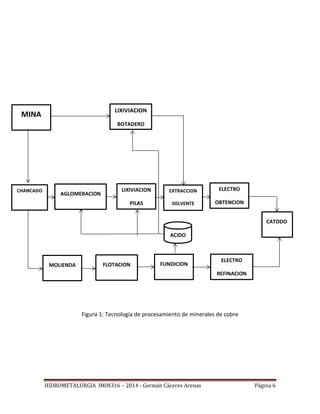
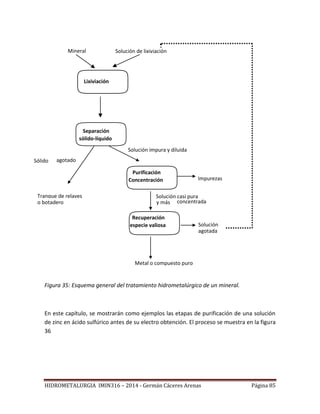
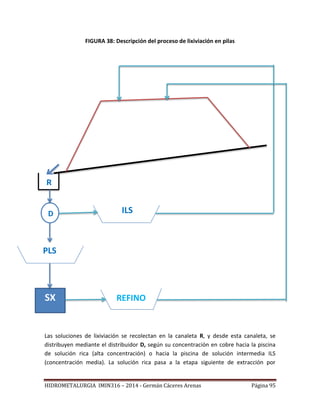
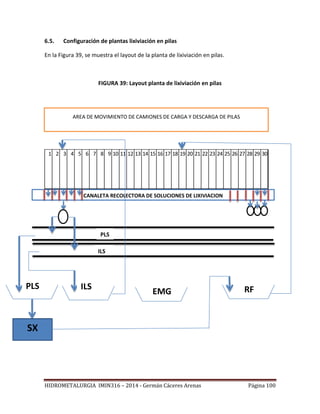
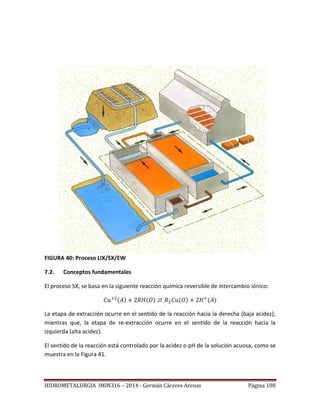
Este documento presenta el plan de estudios de un curso de hidrometalurgia que incluye 9 unidades. La introducción describe los procesos hidrometalúrgicos principales de disolución selectiva, concentración/purificación de soluciones y precipitación de metales. Las unidades cubren temas como fundamentos termodinámicos, lixiviación, separación sólido-líquido, purificación de soluciones y procesos hidrometalúrgicos para cobre y oro.
















![HIDROMETALURGIA IMIN316 – 2014 - Germán Cáceres Arenas Página 20
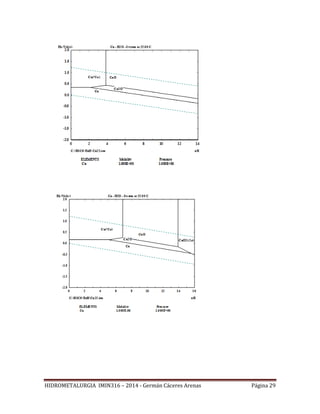
Figura 5: Representación del equilibrio químico Cu2+/CuO, cuando [Cu2+]=1mol/l.
La figura 5, muestra que si la concentración de Cu2+ es de 1 mol/litro, el óxido de cobre
CuO precipita a un pH igual o superior a 3.95, independientemente del Eh.
b) CuO + H2O <=> HCuO2- + H+ = 25.670 cal
A partir del , se calcula la relación de equilibrio siguiente :
Este pH es mayor que 14, el límite superior de un diagrama Eh - pH convencional.
del CuO
Zona de
estabilidad
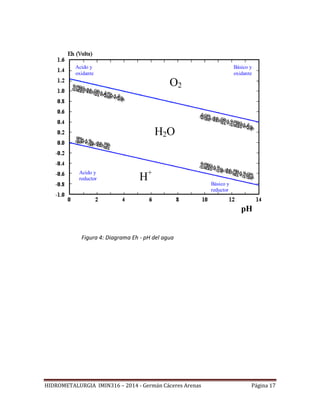
Eh
pH3.95
Zona de
estabilidad
del Cu(2+)](https://image.slidesharecdn.com/hidrometalurgia-171206061810/85/Hidrometalurgia-20-320.jpg)

![HIDROMETALURGIA IMIN316 – 2014 - Germán Cáceres Arenas Página 22
Si hay 2 especies en solución, la línea de equilibrio se define donde las actividades de las
dos especies son iguales.
Figura 6. Representación del equilibrio químico HCuO2- <=> CuO22- + H+
Ese equilibrio no se dibuja en el diagrama de Pourbaix porque HCuO2
2-
no existe a pH <
18.95. En la construcción del diagrama, algunas líneas generadas mediante los cálculos
termodinámicos deben ser eliminados total o parcialmente, ya que representan
equilibrios que no tienen significado en la práctica.
Cu2O + 2 H+ <=> 2 Cu+ + H2O
pH = -0.85 Al equilibrio, si [Cu+] = 1 mol/l.
Eh
pH13.15
HCuO2
-
CuO2
2-
[HCuO2(-)] >> [CuO2(2-)] [HCuO2(-)] << [CuO2(2-)]](https://image.slidesharecdn.com/hidrometalurgia-171206061810/85/Hidrometalurgia-22-320.jpg)



![HIDROMETALURGIA IMIN316 – 2014 - Germán Cáceres Arenas Página 26
Figura 8. Diagrama Eh - pH del sistema Cu - H2O
( T = 25°C, actividades = 1 ( [iones]=1 ) , P = 1 atm )](https://image.slidesharecdn.com/hidrometalurgia-171206061810/85/Hidrometalurgia-26-320.jpg)

![HIDROMETALURGIA IMIN316 – 2014 - Germán Cáceres Arenas Página 28
Influencia de la concentración de los iones
El diagrama ha sido trazado para actividades unitarias. Si se traza para otras actividades,
por ejemplo 10-6 (diagramas de corrosión), aumentan el dominio de estabilidad de los
iones, pero el diagrama mantiene su forma produciéndose sólo desplazamientos paralelos
de las rectas que limitan a estos iones.
Por ejemplo, reemplazando en (13) el valor numérico de [Cu2+]=10-6, se llega a:
=> pH = 6.95
En este caso, el pH de precipitación de CuO aumenta hasta 6.95; se amplía el rango de
estabilidad de los iones en solución.](https://image.slidesharecdn.com/hidrometalurgia-171206061810/85/Hidrometalurgia-28-320.jpg)







![HIDROMETALURGIA IMIN316 – 2014 - Germán Cáceres Arenas Página 37
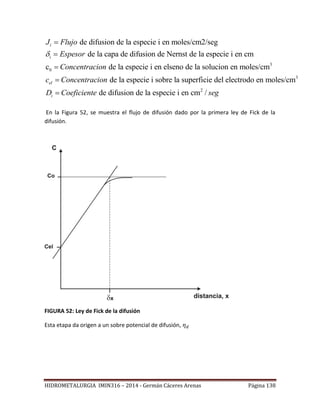
Primera ley de FICK
La primera ley de FICK relaciona la cantidad de material que difunde por unidad de tiempo
en una dirección perpendicular a un plano de referencia de área unitaria con el gradiente
de concentración de este:
J : Flujo de material a través de un plano de referencia. [
moles cm-2 s-1 ]
C : Concentración de la especie disuelta [ moles cm-3 ]
x : Coordenada de posición (medida perpendicularmente
al plano de referencia)
D : Coeficiente de difusión de la especie considerada en
solución acuosa. En el sistema cgs, D tiene las
dimensiones [cm2/s]. En la mayoría de los sistemas
hidrometalúrgicos se introduce poco error al
considerar el coeficiente de difusión constante e
independiente de la concentración. (Valor aprox. =
10-6 cm2/s )
Capa de difusión
La capa de difusión es una delgada capa de líquido adyacente a la interface sólido - líquido
y que prácticamente se adhiere al sólido, debido a que es necesario que la velocidad de la
solución sea nula en la interfase con el sólido. El transporte de masa de especies disueltas
a través de esa capa de líquido adherido al sólido se hace por difusión.
NERNST propone la siguiente aproximación de la ecuación de Fick, por linearización en
x=0:
C0 : Concentración de la especie en el seno de la solución
Cs : Concentración de la especie en la superficie del sólido](https://image.slidesharecdn.com/hidrometalurgia-171206061810/85/Hidrometalurgia-37-320.jpg)



![HIDROMETALURGIA IMIN316 – 2014 - Germán Cáceres Arenas Página 41
Absorción de gases en líquidos
La termodinámica determina la concentración de un gas disuelto en solución después de
un tiempo de contacto gas - líquido suficiente para alcanzar el equilibrio. Por ejemplo, si
PO2 = 0.21 atm, [O2]disuelto = 8 mg/l (25 °C).
| |
| |
La absorción de los gases en líquidos puede ser la etapa limitante si hay un gran consumo
de oxígeno y cuando la cinética de reacción sólido - solución es rápida (ej.: Oxidación de
los sulfuros a presión o biológicamente).
La velocidad de absorción de gases en un líquido depende de:
(1) Superficie de contacto gas - líquido efecto positivo
(Mayor cuando hay muchas burbujas pequeñas)
(2) Velocidad relativa de las burbujas efecto positivo
(3) Presión parcial del gas efecto positivo
(4) Grado de agitación efecto positivo
(5) Temperatura efecto negativo
2.4. Influencia de las características de las partículas
Tamaño de las partículas
La superficie de reacción aumenta cuando disminuye el tamaño de las partículas.
Forma y textura de las partículas](https://image.slidesharecdn.com/hidrometalurgia-171206061810/85/Hidrometalurgia-41-320.jpg)












![HIDROMETALURGIA IMIN316 – 2014 - Germán Cáceres Arenas Página 58
Figura 20, Esquema de un sistema de lixiviación en pilas.
SX
0.5 g/l Cu
[ácido] élevada
Ultimos días
Piscina refino
ácido
Piscina solución intermedia
3 g/l Cu
[ ácido ] debil
Primeros días
6 g/l Cu
Piscina solución rica
SX
Pila
Figura 21: Reciclaje de la solución lixiviante en contra - corriente.](https://image.slidesharecdn.com/hidrometalurgia-171206061810/85/Hidrometalurgia-58-320.jpg)






![HIDROMETALURGIA IMIN316 – 2014 - Germán Cáceres Arenas Página 67
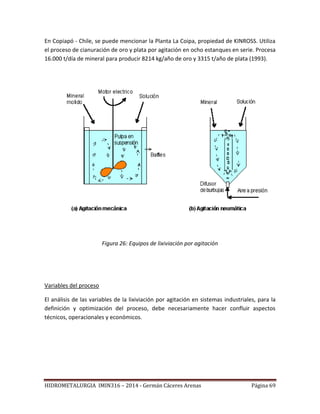
Variables del proceso
Se puede estudiar el efecto de varias variables operacionales sobre la recuperación del
metal valioso y la cinética, realizando pruebas de laboratorio en columnas.
Las principales variables son:
La granulometría
La altura de la pila
La tasa de riego [l/h.m2
]
La razón de lixiviación, m3
/TMS
La concentración en ácido de la solución de riego
El tiempo de lixiviación (depende de la cinética: química, 2 a 4 meses; bacterial, 6 a
12 meses)
Todos estos factores están relacionados entre sí.
Por ejemplo, si se aumenta la altura de la pila, la concentración en ácido del primer metro
es buena, pero baja a medida que la solución percola en la pila y el cobre de los estratos
inferiores no se lixivia bien. Se puede aumentar la concentración en ácido de la solución
de lixiviación, para salir de la pila con +/- 3 g/l [H+], pero mientras más ácido se da a la
ganga, más ésta consume, así que se va a incrementar el consumo de ácido. Otra
posibilidad es aumentar la tasa de riego, pero existe un riesgo de inundar la pila.](https://image.slidesharecdn.com/hidrometalurgia-171206061810/85/Hidrometalurgia-67-320.jpg)


































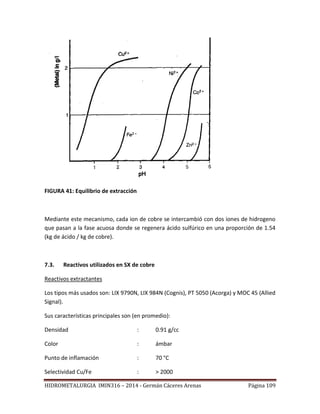



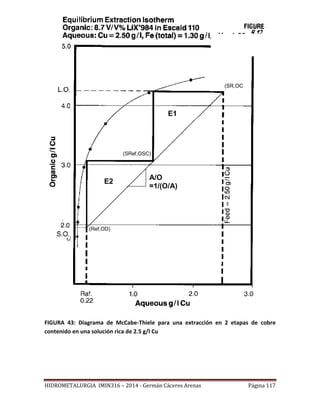
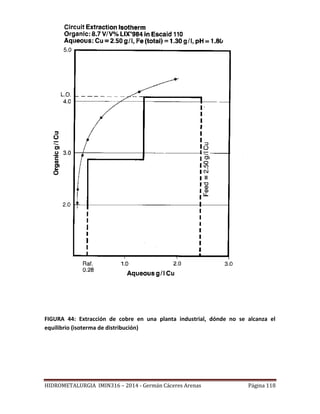
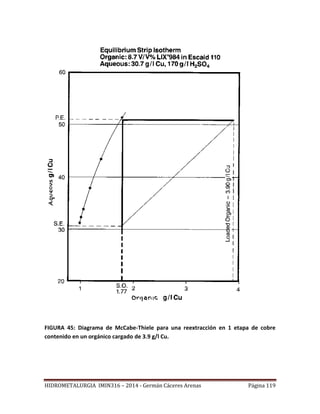
![HIDROMETALURGIA IMIN316 – 2014 - Germán Cáceres Arenas Página 113
FIGURA 42: Construcción una isoterma de extracción.
Recta de operación
Como se ha se señalado, la mayoría de los procesos industriales de SX operan con un
sistema de contacto múltiple en contra corriente. La Figura 43, representa
esquemáticamente la operación de la parte extracción de una planta de SX para lo cual se
han supuesto n etapas de extracción. En un proceso de extracción en contra corriente, la
solución acuosa y la solución orgánica fluyen en direcciones opuestas. Entonces, el
orgánico descargado se contacta con el refino, pobre en Cu, mientras que el orgánico
cargado está en contacto con la solución rica en Cu. El proceso de extracción en contra
corriente permite tener una buena extracción del metal contenido en la solución acuosa, y
a la vez usar eficientemente el reactivo orgánico.
[Me] en
orgánico (g/l)
[Me] en el
acuoso (g/l)](https://image.slidesharecdn.com/hidrometalurgia-171206061810/85/Hidrometalurgia-113-320.jpg)