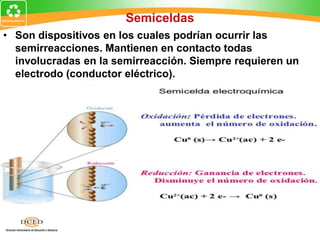
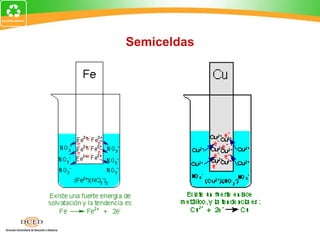
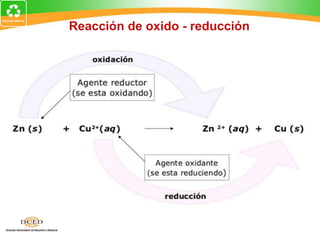
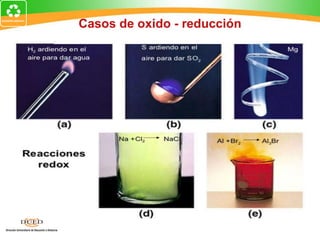
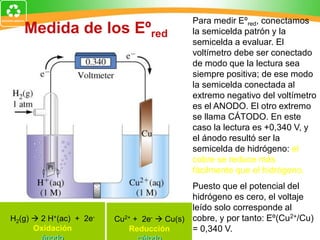
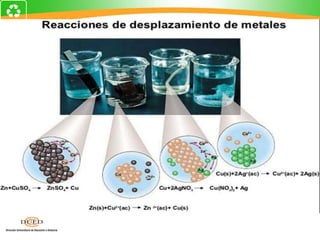
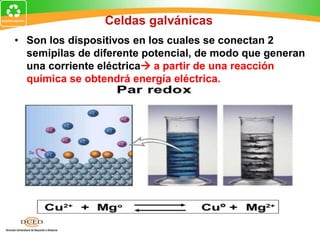
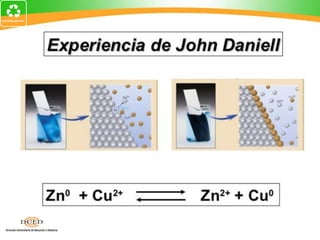
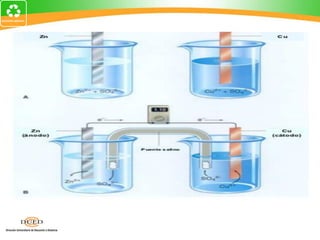
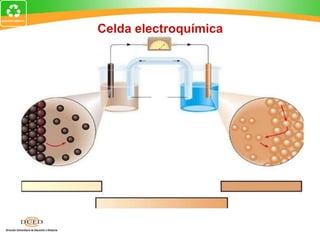
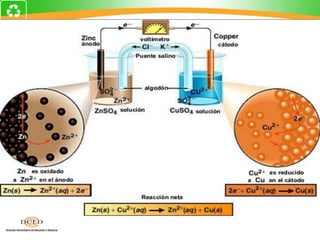
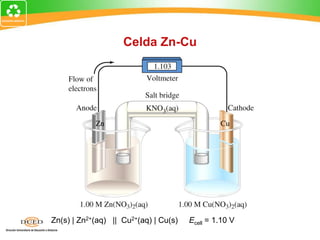
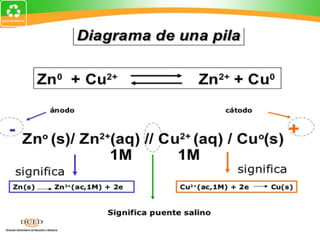
Este documento trata sobre electroquímica y procesos redox. Explica conceptos clave como semiceldas, potenciales estándar de redox, celdas galvánicas y electrólisis. Incluye ejemplos como la celda Zn-Cu y reacciones espontáneas basadas en los potenciales redox.