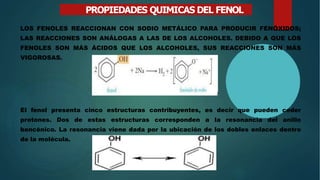
Los fenoles son compuestos orgánicos con un grupo hidroxilo unido a un anillo aromático, presentando propiedades físicas y químicas variadas. Tienen aplicaciones significativas en la farmacéutica debido a sus propiedades antioxidantes, antimicrobianas, antiinflamatorias, y como analgésicos. Su síntesis más común se realiza a partir de benceno mediante hidrólisis u oxidación.



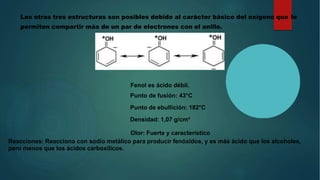
![PROPIEDADES FISICAS DEL FENOL
EL FENOL SE PRESENTA COMO UN SÓLIDO CRISTALINO QUE SE OXIDA FÁCILMENTE
CON LA LUZ O CON EL AIRE, TOMANDO UNA COLORACIÓN ROJIZA. ES
MODERADAMENTE SOLUBLE EN AGUA, PERO ES MUY SOLUBLE EN ALCOHOL Y ÉTER.
Estado físico: Sólido a temperatura ambiente.
Apariencia: Blanco-incoloro
Densidad: 1070 kg/m³ o 1,07 g/cm³
Masa molar: 9411 g/mol
Punto de fusión: 40,5 °C (314 K)
Punto de ebullición: 181,7 °C (455 K)[5]](https://image.slidesharecdn.com/jesusdiapositivas2024-240625171343-d8511d97/85/JESUS-DIAPOSITIVAS-2024-pptx-bioquimicaf-5-320.jpg)