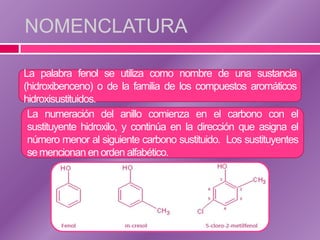
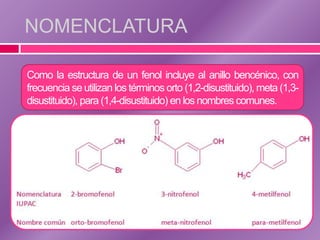
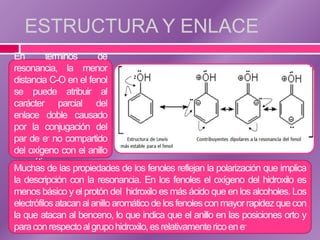
El documento trata sobre los fenoles, compuestos que contienen un grupo hidroxilo unido a un anillo bencénico, discutiendo su nomenclatura, estructura, propiedades físicas y químicas. Se destaca su reactividad en reacciones de sustitución electrofílica y su capacidad para formar enlaces de hidrógeno, lo que influye en su solubilidad y propiedades. También se abordan métodos analíticos como espectroscopía IR, RMN y espectrometría de masas para caracterizarlos.