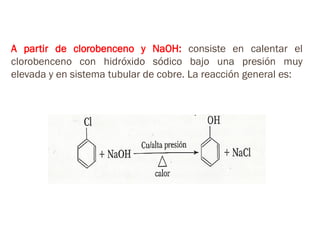
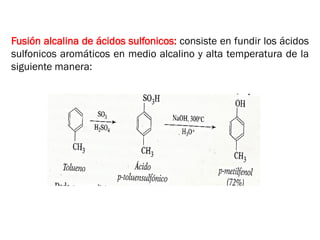
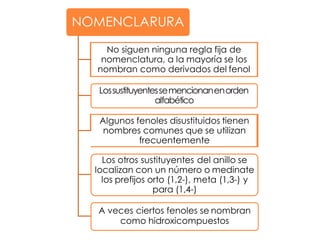
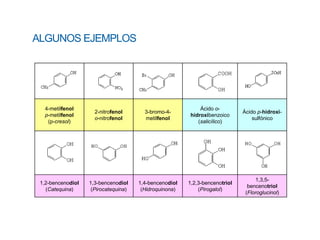
Este documento describe los fenoles. Los fenoles son compuestos orgánicos aromáticos que contienen uno o más grupos hidroxilo unidos directamente al anillo aromático. Se caracterizan por su acidez débil y reactividad. Algunos ejemplos incluyen el fenol, cresoles, ácidos hidroxibenzóicos y catequinas.