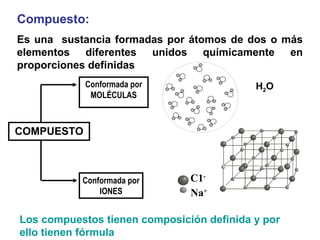
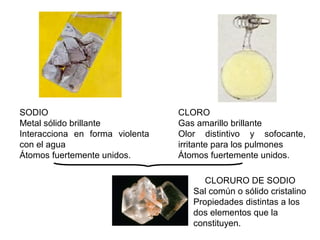
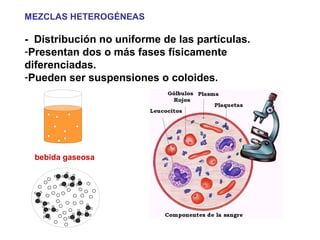
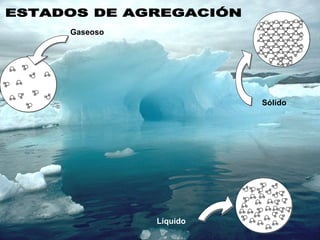
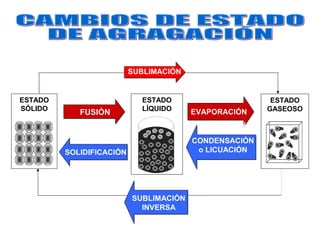
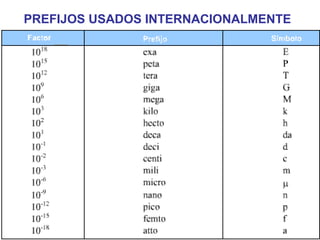
El documento define conceptos básicos de química como la materia, los elementos y compuestos, y los diferentes estados de la materia. Explica que la química estudia la materia y sus cambios, y que la materia está compuesta de partículas a nivel atómico y molecular. También describe propiedades físicas y químicas de las sustancias y las unidades utilizadas para medirlas.