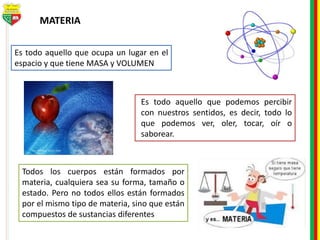
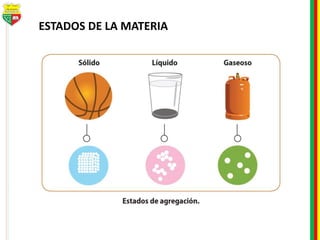
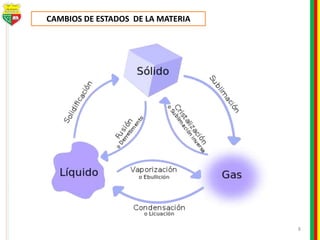
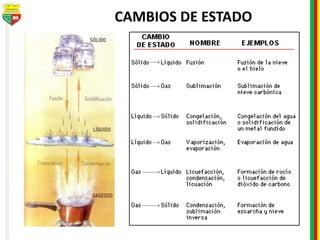
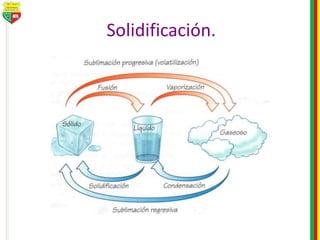
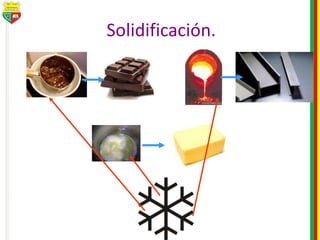
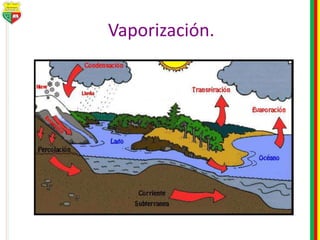
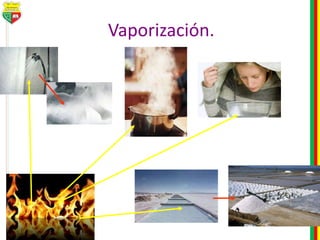
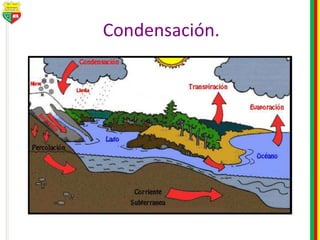
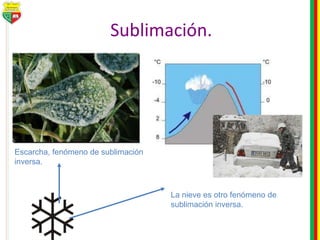
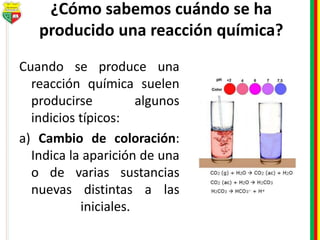
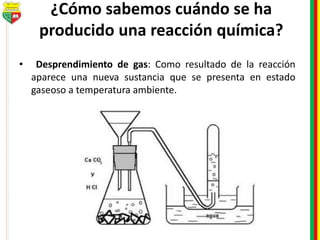
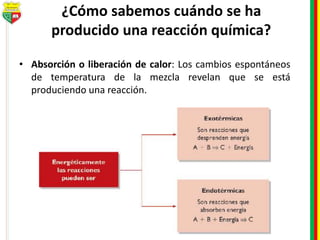
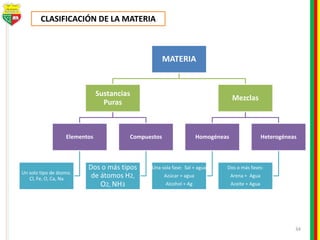
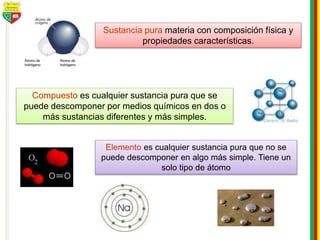
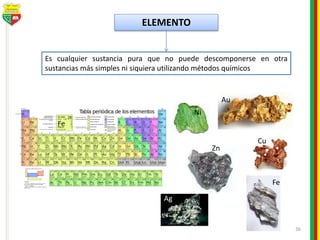
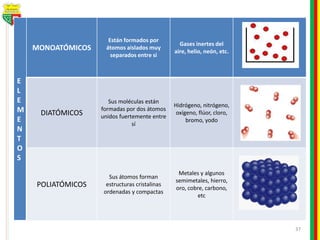
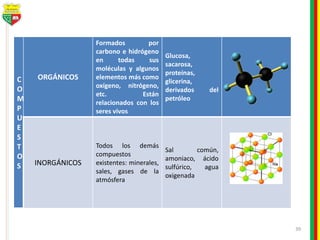
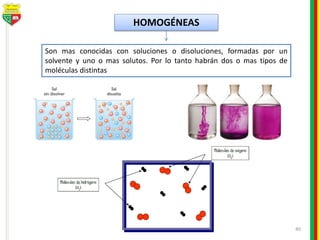
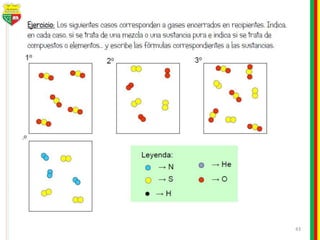
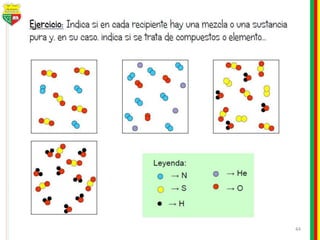
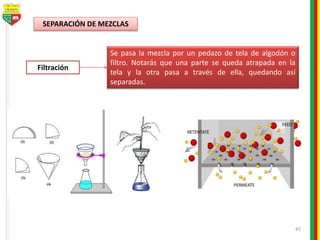
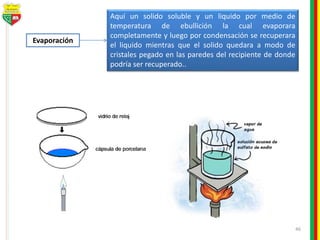
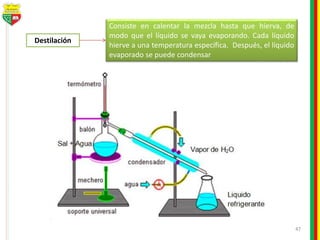
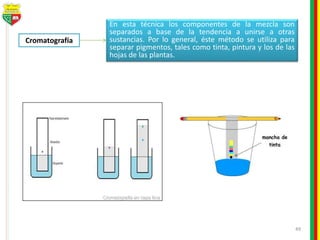
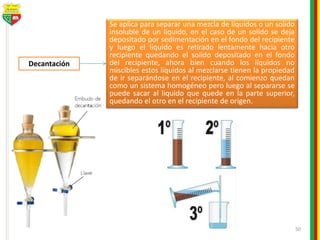
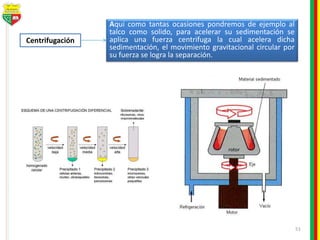
Este documento describe los diferentes estados de la materia, las transformaciones entre estados, y los cambios físicos y químicos que puede experimentar la materia. Explica que la materia puede presentarse en estado sólido, líquido, gaseoso o plasma, y describe los procesos de cambio de estado como la fusión, solidificación, vaporización, condensación y sublimación. También distingue entre cambios físicos y químicos, y proporciona ejemplos de cada uno.