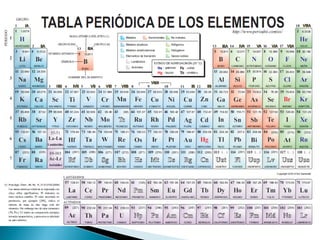
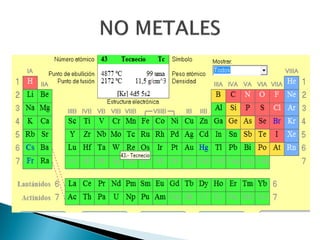
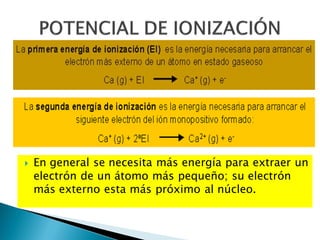
Este documento resume la historia y principios de la tabla periódica de los elementos. Explica cómo los científicos inicialmente ordenaron los elementos basados en su masa atómica, y cómo Mendeleev creó la primera tabla periódica que dejaba espacios para elementos aún no descubiertos. También describe cómo Moseley ordenó los elementos basados en su número atómico y estableció la ley periódica. Finalmente, resume las características de los grupos principales de elementos en la tabla periódica.