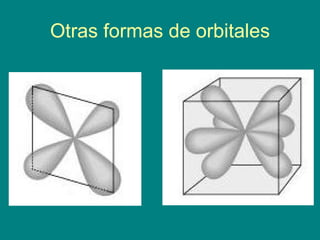
El modelo atómico actual se basa en la mecánica cuántica, donde los electrones no tienen trayectorias fijas y se encuentran en orbitales que representan zonas de alta probabilidad de ubicación. Existen diferentes niveles de energía y subniveles, que se describen mediante orbitales atómicos de diversas formas, como los orbitales s y p. La configuración electrónica define la distribución de los electrones en estos niveles, como se ejemplifica con los átomos de hidrógeno y cloro.