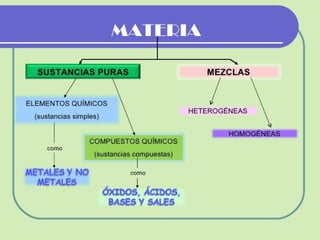
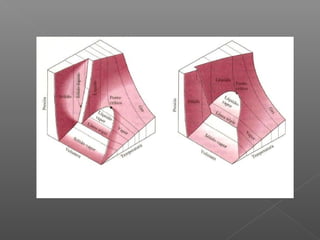
El documento describe los diferentes estados de equilibrio que puede presentar una sustancia pura, incluyendo las fases líquida, sólida y vapor. Explica que el agua puede encontrarse como líquido y vapor dentro de una olla a presión, o como hielo sólido a temperatura y presión normales. Además, introduce los conceptos de línea de saturación, punto crítico y superficie termodinámica P-v-T para representar gráficamente los estados de equilibrio de una sustancia.