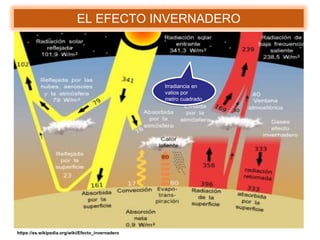
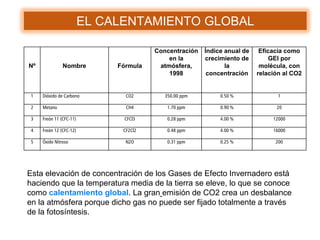
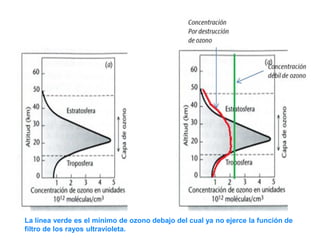
Este documento presenta información sobre tres problemas ambientales globales: el calentamiento global, el agujero de la capa de ozono y la lluvia ácida. Describe las causas, procesos y efectos de cada problema, así como medidas para mitigarlos. Explica que el calentamiento global está causado por el aumento de gases de efecto invernadero como el dióxido de carbono, mientras que el agujero de ozono es causado por compuestos de cloro. También analiza los impactos negativos de estos problemas en el medio ambiente y