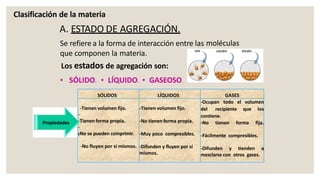
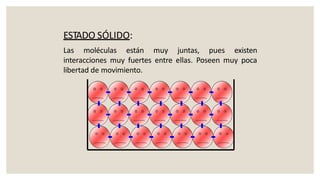
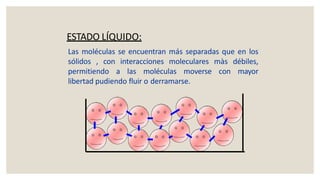
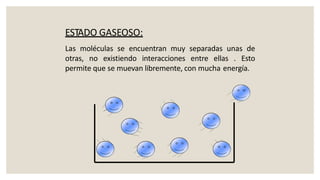
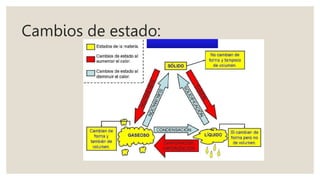
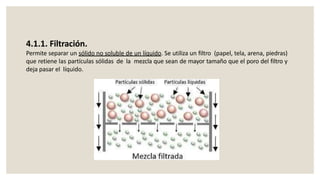
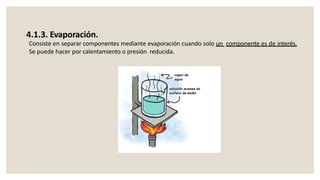
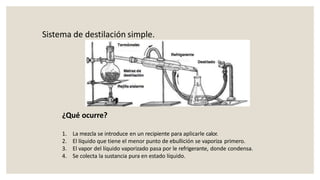
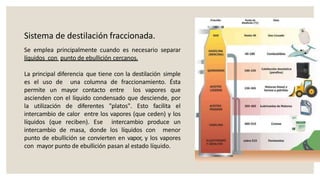
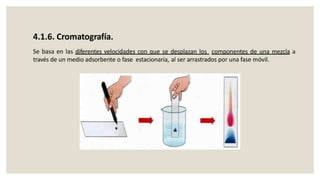
Este documento presenta información sobre química y materia. Explica que la química estudia la composición y transformaciones de la materia a nivel atómico. Define materia y clasifica los tipos de fenómenos químicos y físicos. Describe los estados de agregación de la materia y los cambios de estado. Finalmente, distingue entre sustancias puras, mezclas y sus métodos de separación.