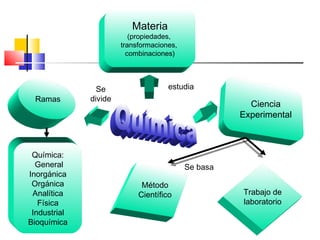
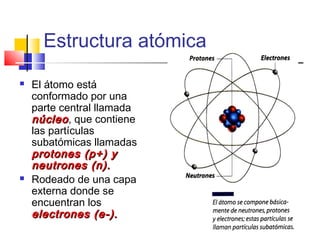
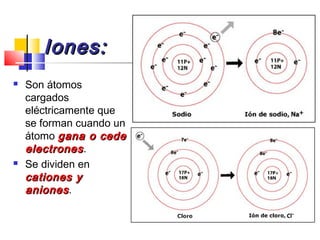
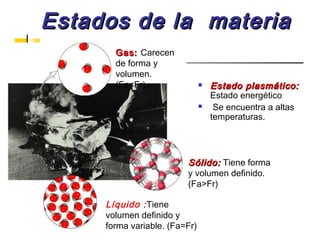
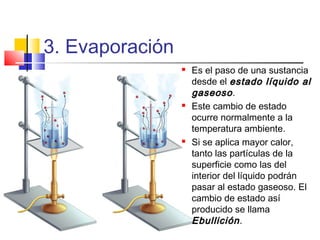
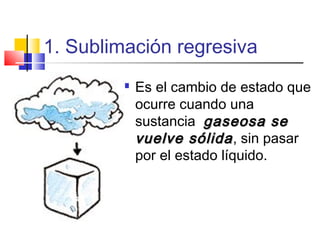
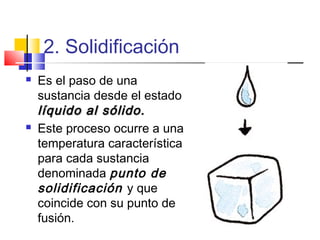
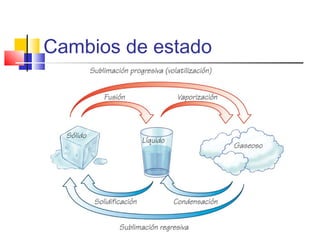
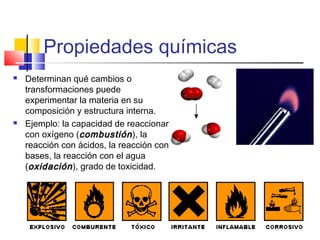
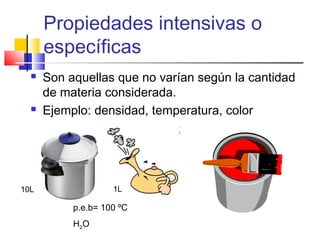
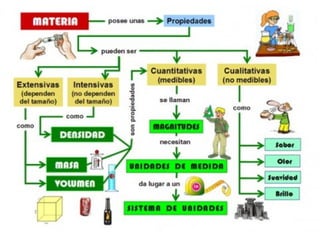
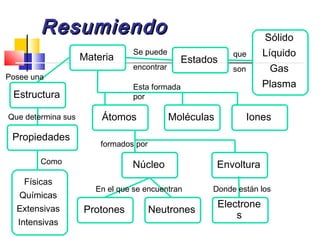
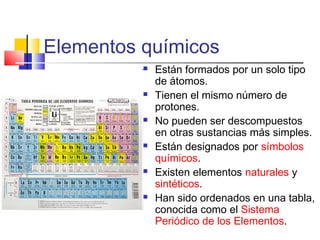
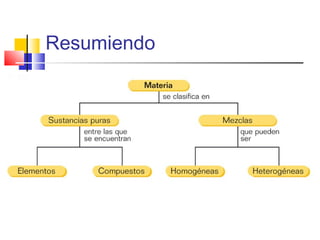
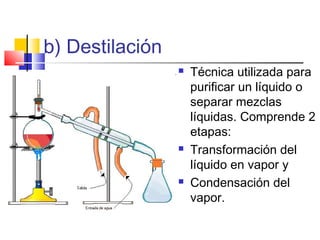
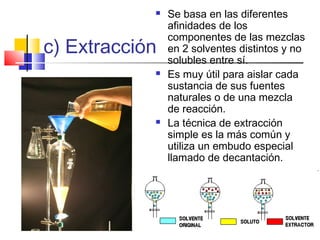
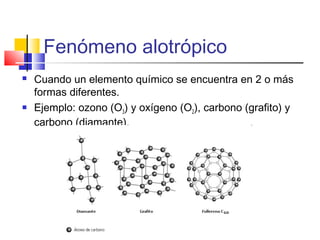
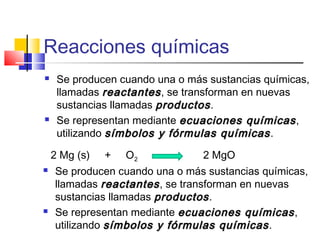
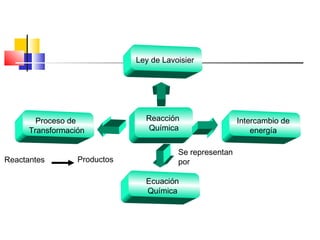
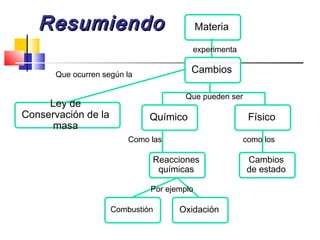
Este documento introduce conceptos básicos de química. Explica que la materia está compuesta de átomos, moléculas e iones, y puede encontrarse en tres estados: sólido, líquido y gaseoso. Describe las propiedades físicas y químicas de la materia, así como las sustancias puras y mezclas. Además, distingue entre cambios físicos, químicos y alotrópicos que experimenta la materia.