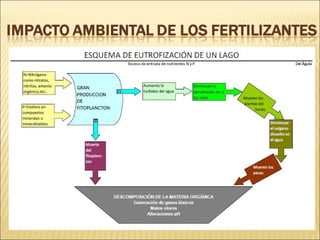
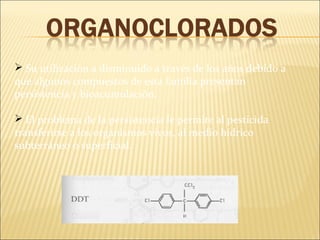
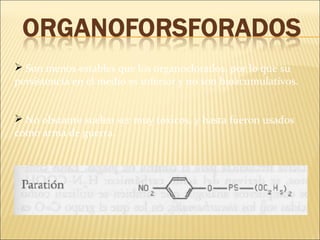
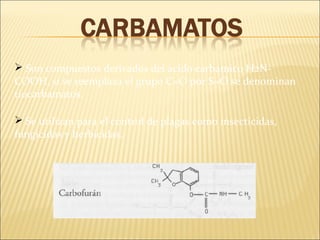
Este documento describe las propiedades del suelo y su capacidad para retener y degradar contaminantes como metales pesados, fertilizantes y pesticidas. Explica que el suelo puede degradar la materia orgánica a través de procesos biológicos y químicos, y retiene contaminantes a través de la adsorción e intercambio iónico. También describe cómo factores como el pH, humedad y microorganismos afectan la degradación de contaminantes en el suelo.