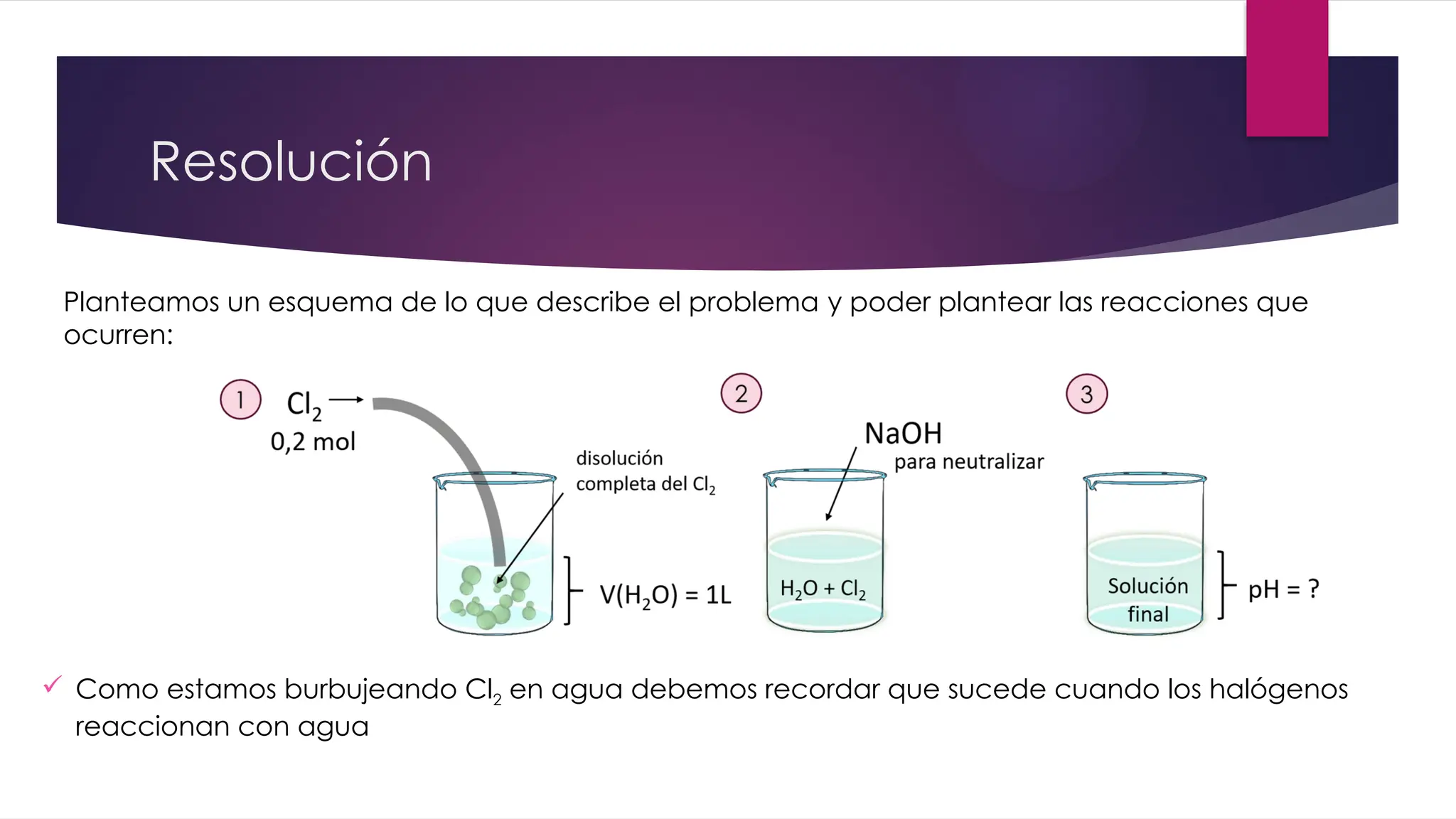
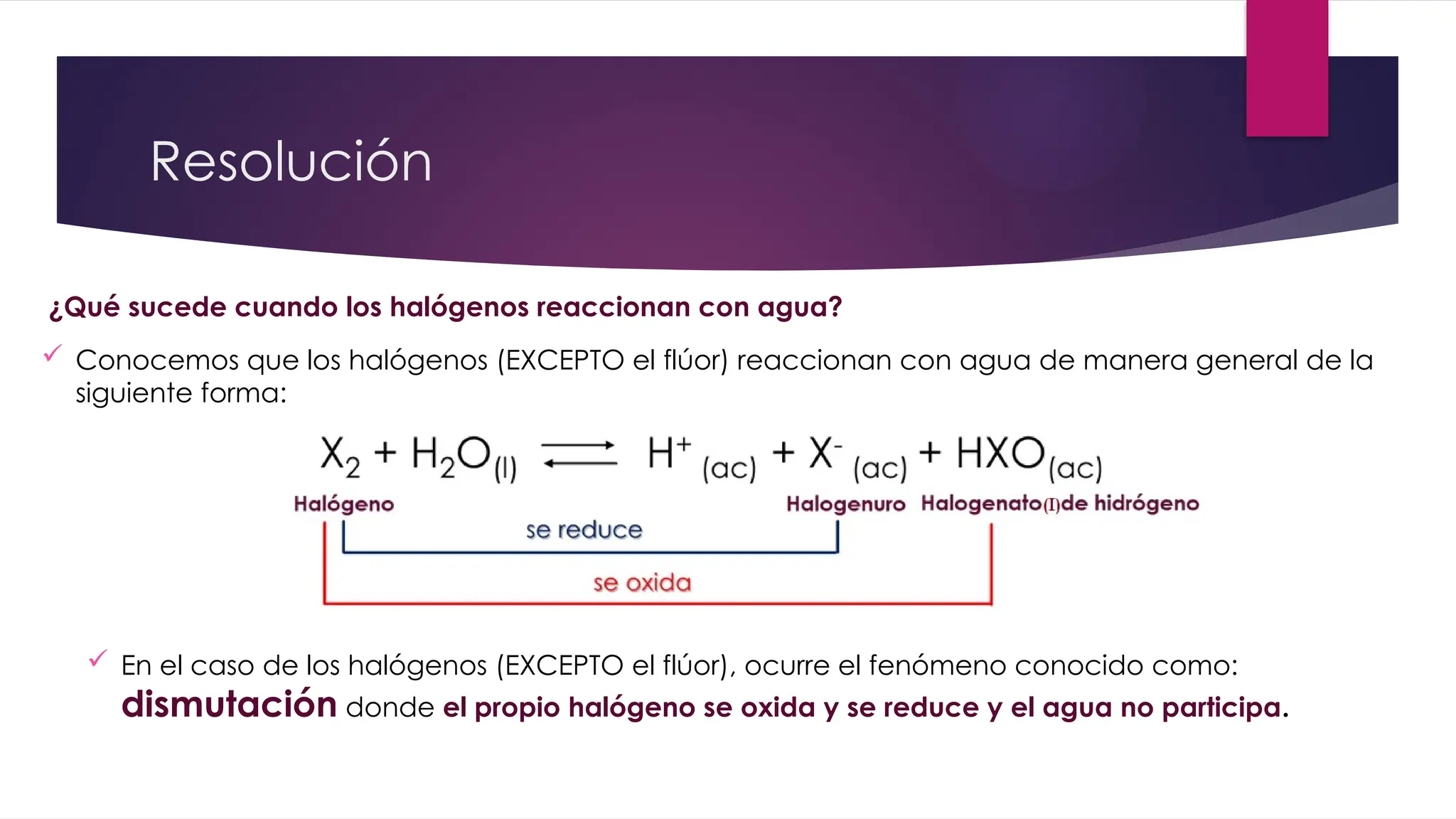
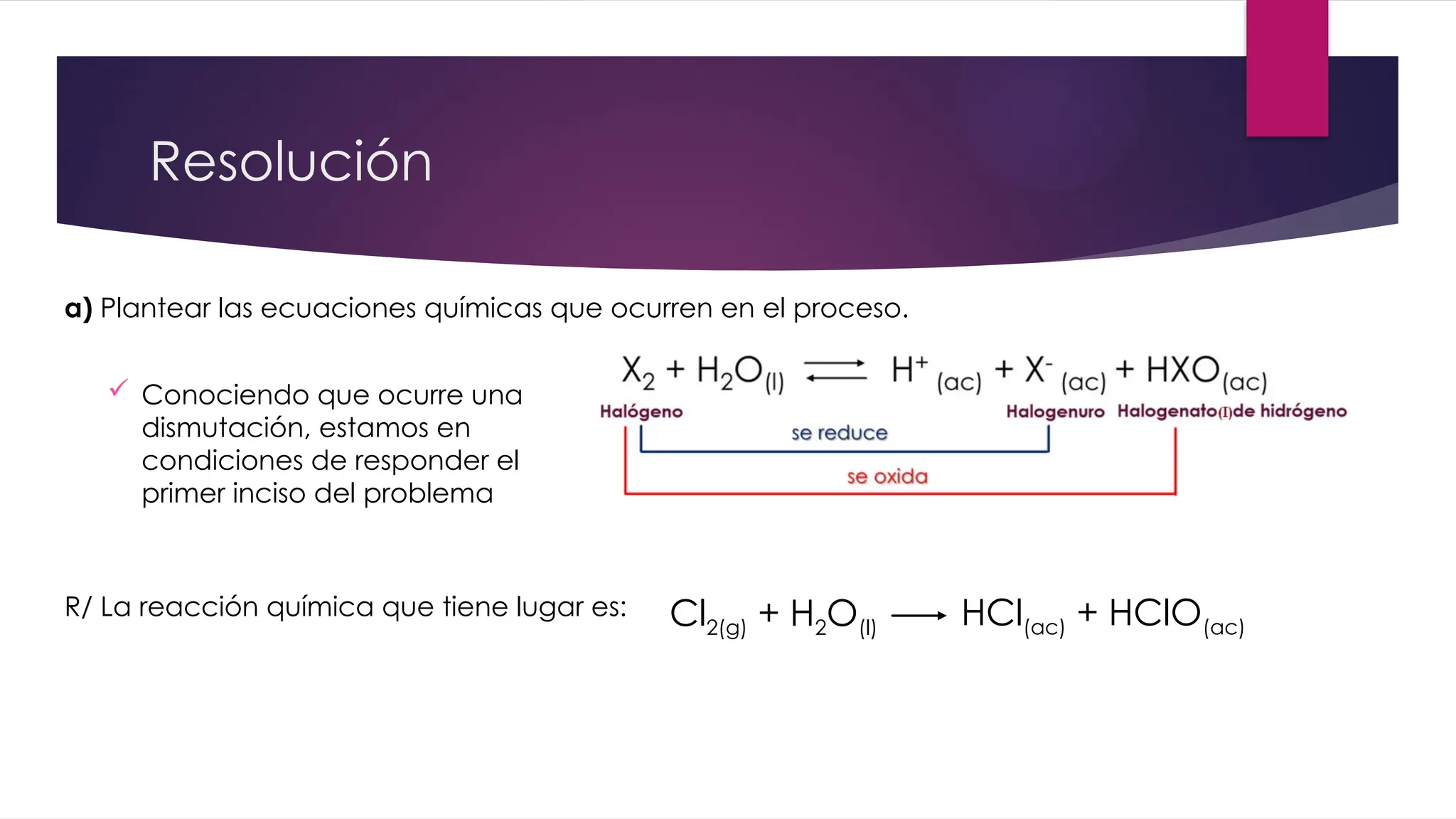
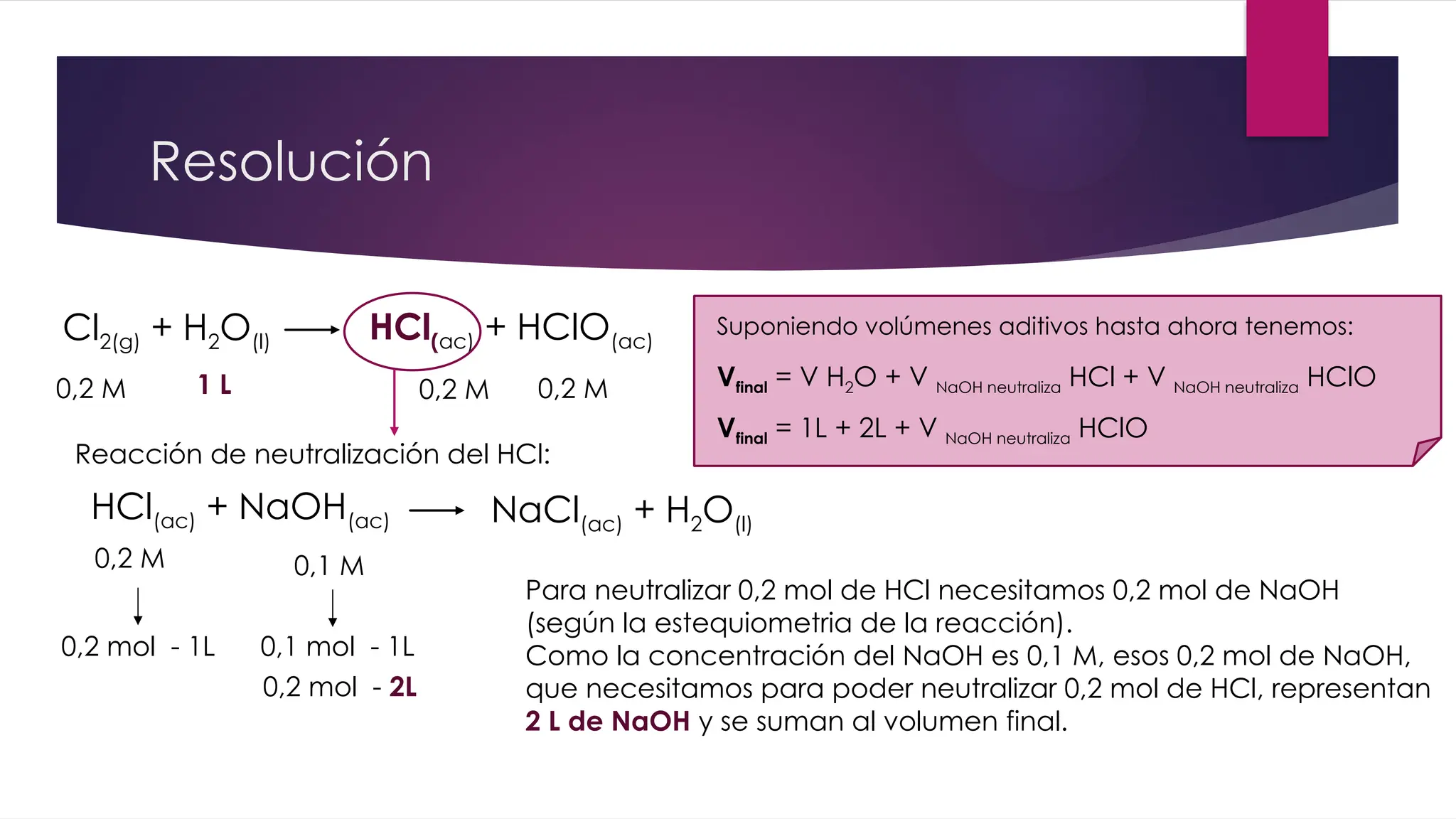
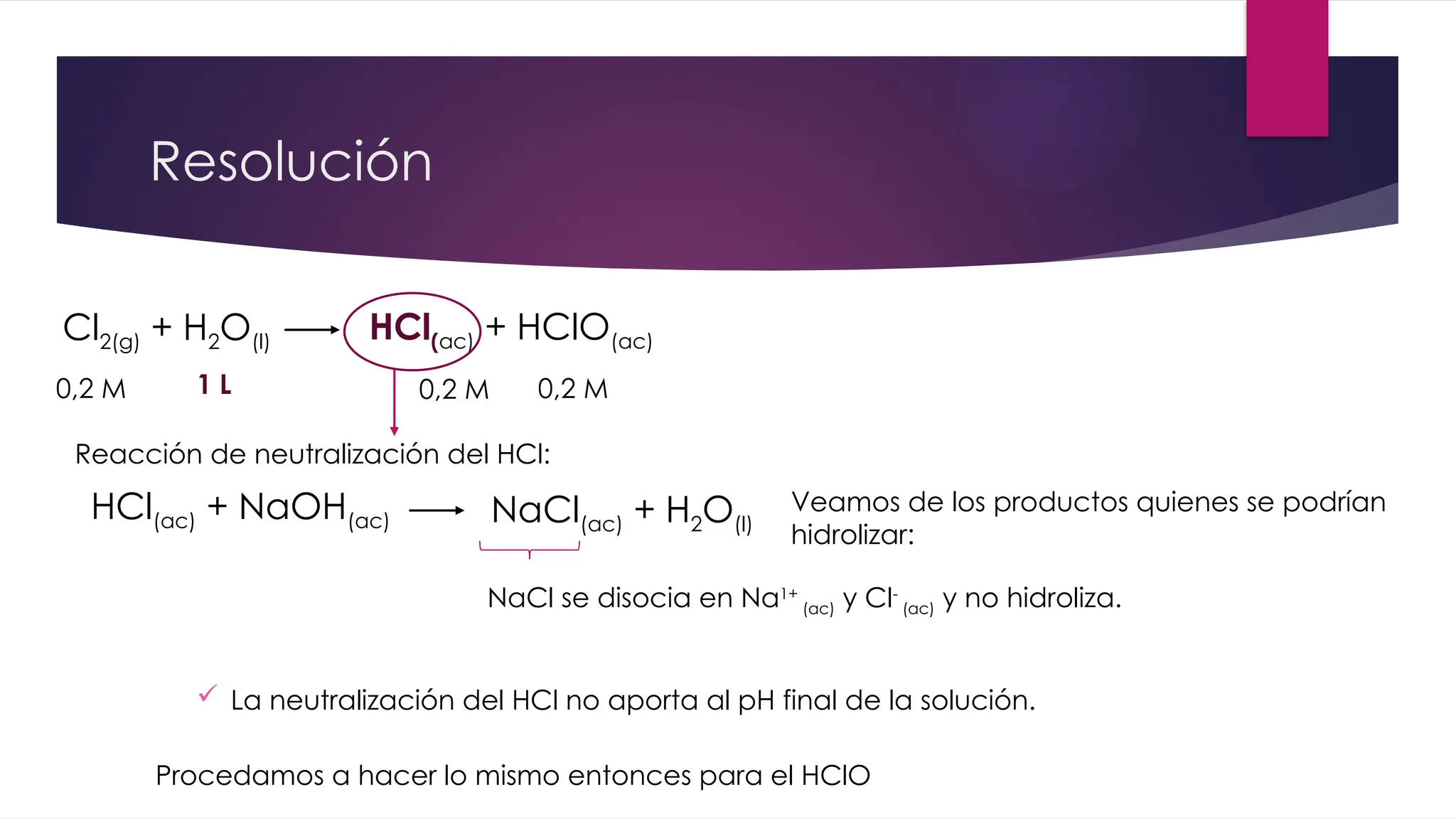
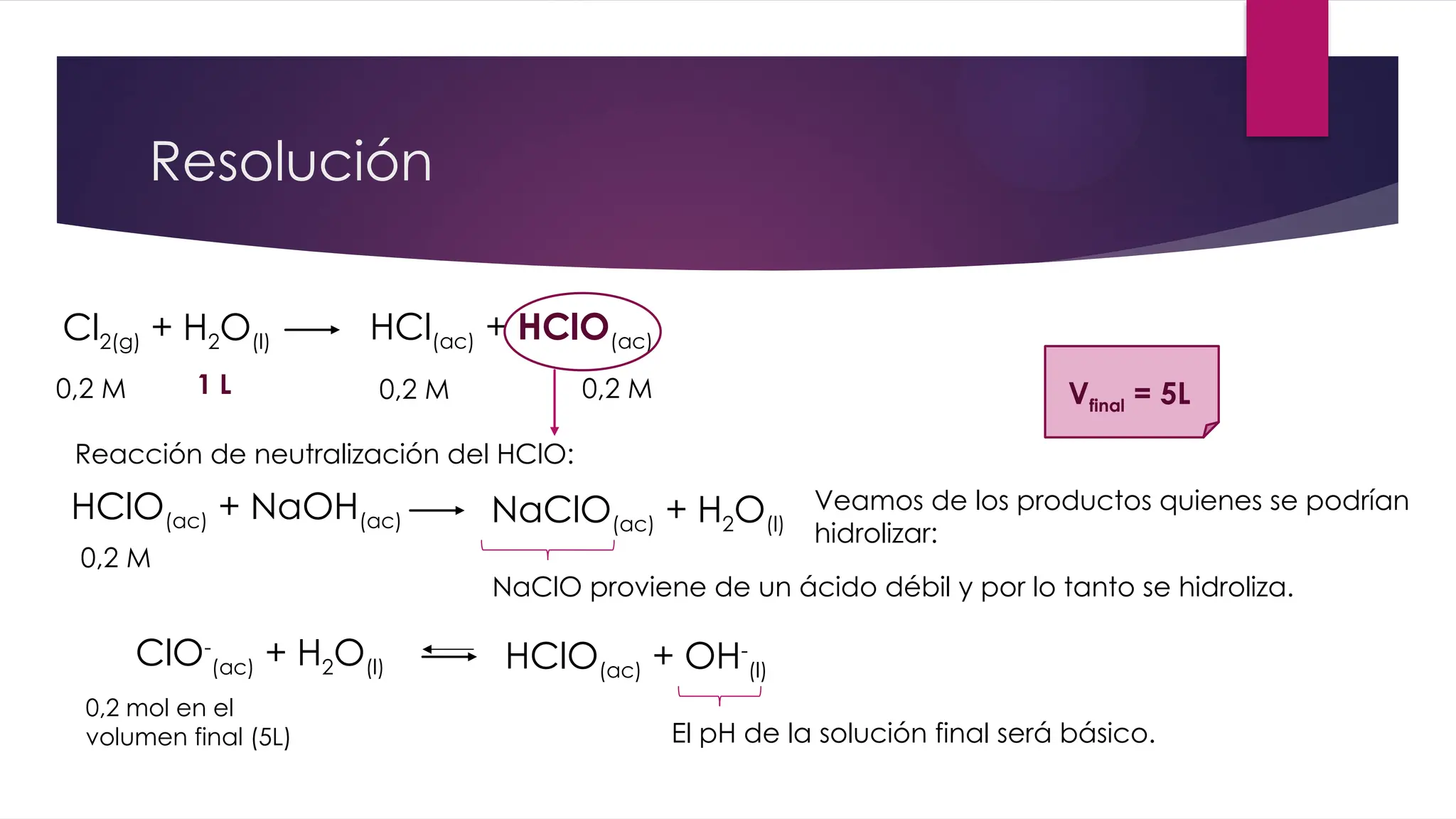
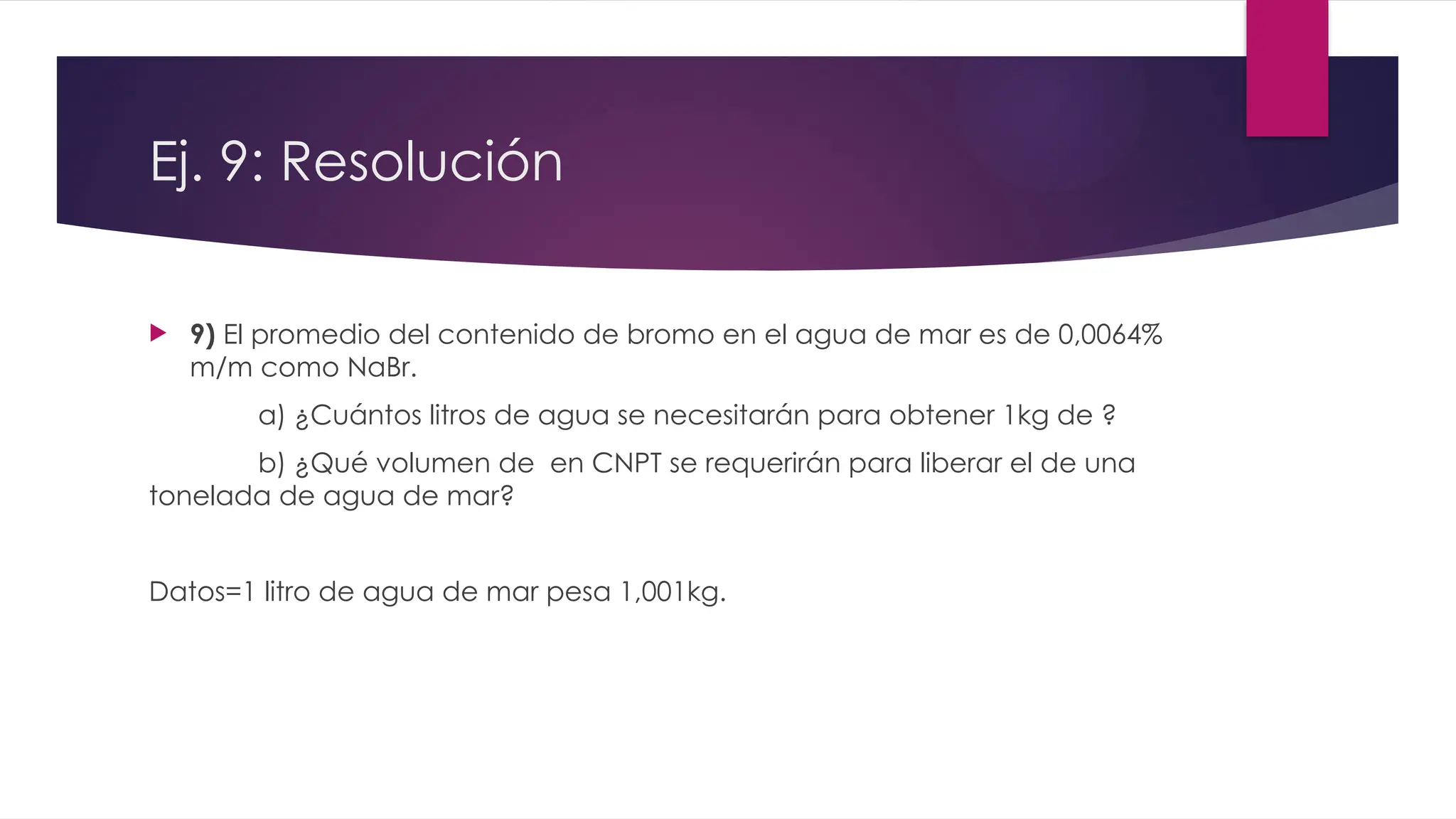
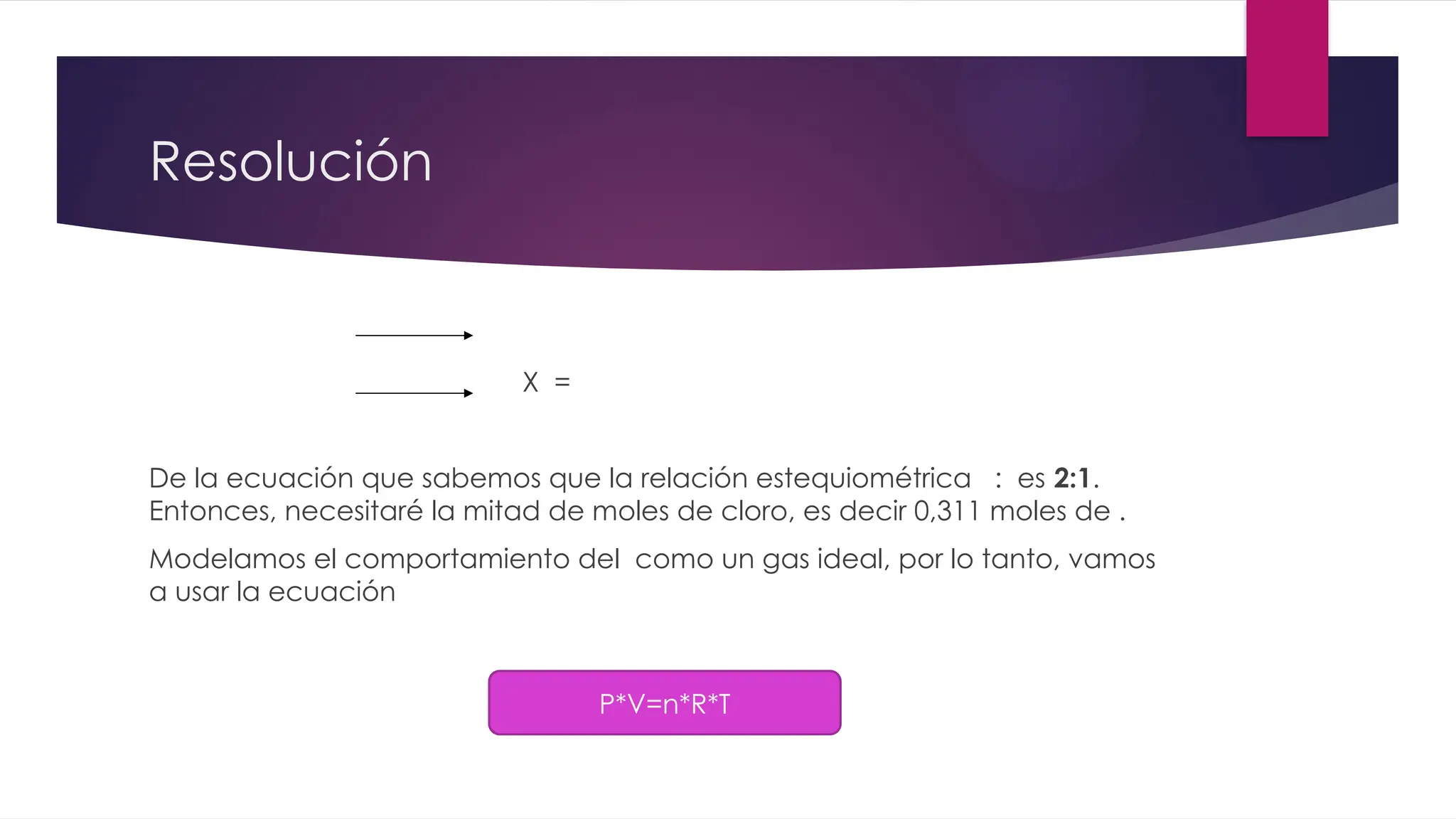
El documento detalla la obtención de 100 litros de cloro líquido a partir de una mezcla de reactivos, incluyendo sulfato de sodio, material inerte y cloruro de sodio, con cuentas estequiométricas y cálculos relacionados. Calcula las masas necesarias de los reactivos, considerando la pureza de cada compuesto, y evalúa si un filtro de carbón activado es suficiente para adsorber el cloro que se escapa. También se analizan reacciones químicas que ocurren al burbujear cloro en agua y su neutralización con NaOH, junto con un análisis del pH final de la solución resultante.
















![Resolución
ClO-
(ac) + H2O(l) HClO(ac) + OH-
(l)
Esta reacción tiene asociado un valor
de Kb debido a la presencia de OH-
0,2 mol en 5L
0,04 M
Kb=
KW
Ka
(dato)
=
1∙10-14
3,2 ∙10-8
= 3,125 ∙10-7
ClO-
(ac) + H2O(l) HClO(ac) + OH-
(l)
0,04 M
Kb= 3,125 ∙10-7
Con estos datos estamos en condiciones de calcular con un sistema de ecuaciones la concentración
de OH-
empleando cualquiera de los métodos conocidos.
Se obtienen dos soluciones de las cuales una es descartada por su falta de sentido físico y la otra es el
valor de la concentración de OH-
.
[OH-
] = 1,16 ∙10-4 pOH = 3,94 b) R/ El pH de la solución final es de 10,05
pH + pOH = 14
pH = 10,05](https://image.slidesharecdn.com/resolucindeejshalogenosyhalogenurospara2c2020ltimaversin1-250210194024-0336d26a/75/Resolucion-de-ejs-HALOGENOS-y-HALOGENUROS-23-2048.jpg)



![Resolución
El NaHSO3 viene en solución de concentración 0,075 M
0,075𝑚𝑜𝑙 NaHSO 3
1𝑙 𝑠𝑛
Vsn = * 9,84 mol = 131,2 l sn R/ a)
Molaridad = [M]=
mol st/l sn
También podés
resolverlo con
una regla de
tres simple!!](https://image.slidesharecdn.com/resolucindeejshalogenosyhalogenurospara2c2020ltimaversin1-250210194024-0336d26a/75/Resolucion-de-ejs-HALOGENOS-y-HALOGENUROS-27-2048.jpg)






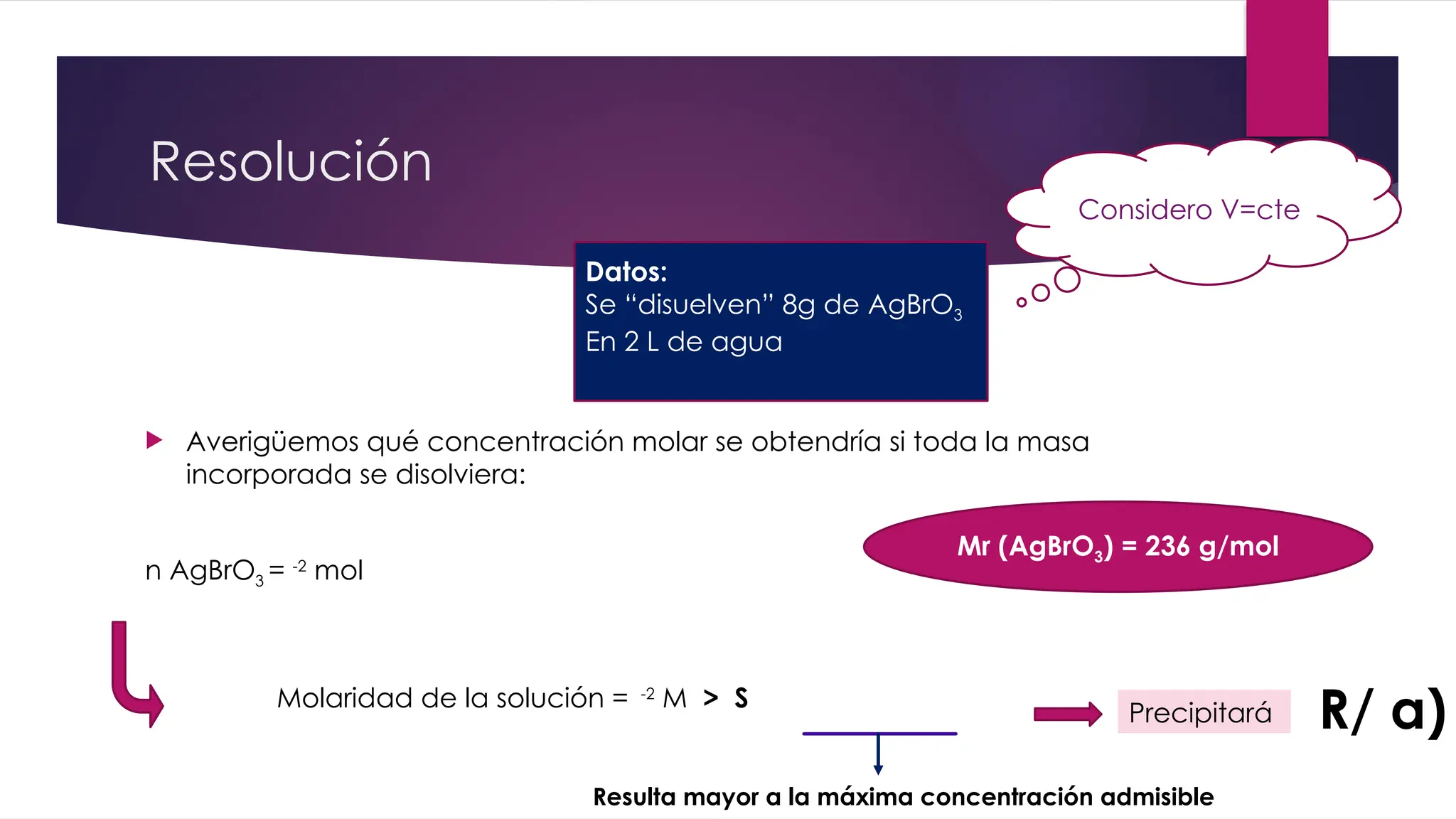
![Resolución
Según el equilibrio de solubilidad para el AgBrO3:
Kps (AgBrO3)= [Ag+
]*[BrO3
-
] = 5,38.10-5
S * S = 5,38.10-5
S2
= 5,38.10-5
S = 7,33.10-3
M
AgBrO3 (s) Ag+
(ac) + BrO3
-
(ac)
En el equilibrio en agua pura
s s
Ésta sería la máxima
concentración admisible de sal
en la solución.
Si lo que agregué, al
“disolverse completamente”
superara este valor, parte de la
masa incorporada al sistema
precipitaría](https://image.slidesharecdn.com/resolucindeejshalogenosyhalogenurospara2c2020ltimaversin1-250210194024-0336d26a/75/Resolucion-de-ejs-HALOGENOS-y-HALOGENUROS-37-2048.jpg)